实验室新手如何快速掌握流式细胞术?
流式细胞术(Flow Cytometry, 简称FC)是一种在生命科学研究和临床诊断中广泛应用的重要技术,能够在短时间内对大量细胞进行高精度的定量分析。无论你是刚踏入实验室的新手,还是刚接触这项技术的研究生,这篇文章都将带你系统、快速地理解并掌握流式细胞术的基本原理、实验流程和常见问题。
图片来源于知乎“ZJUMED科小服”
一、流式细胞术的基本原理
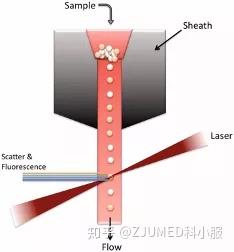
流式细胞术是一种以单细胞为基础的检测技术,主要通过激光照射并检测细胞散射光和荧光信号来判断细胞的物理和生物特性。
当标记有荧光探针(如荧光抗体或染料)的细胞通过鞘流系统进入检测区时,激光束照射每一个细胞并产生两类信号:
散射光(FSC与SSC):反映细胞的大小与内部结构复杂性
荧光信号(FL):反映细胞表面或内部特定分子的表达情况
这些信号随后被转换成电子数据,实现多参数同时分析,从而可用于细胞表型鉴定、功能检测、细胞周期分析等。
二、流式细胞术的常见应用
流式细胞仪在科研和医学领域应用广泛,以下是常见的应用类型:
- 免疫细胞表型分析:识别不同类型的免疫细胞,如T细胞(CD3⁺)、B细胞(CD19⁺)、NK细胞(CD56⁺)。
- 细胞凋亡检测:常用Annexin V与PI染色进行早期与晚期凋亡分析。
- 细胞周期分析:通过DNA染料(如PI)定量分析细胞处于G0/G1、S、G2/M期。
- 细胞活性与功能分析:如检测ROS产生、吞噬活性、细胞增殖等。
- 细胞分选(FACS):对特定细胞群进行分离培养,进行后续实验或建系。
三、实验流程详解
下面以免疫表型分析为例,介绍标准的流式细胞术操作流程。
- 单细胞制备
无论是贴壁细胞、悬浮细胞还是外周血单核细胞(PBMC),首先需要将细胞处理成单细胞悬液,避免聚集和堵管。
细胞浓度建议调整为1×10⁶个/mL
可以使用40μm滤网过滤细胞,去除细胞团聚物
- 抗体染色
选择合适的荧光标记抗体(如FITC-CD3、PE-CD4等),并按照推荐比例(如1:100)进行孵育。
染色通常在4°C避光孵育20–30分钟
实验中应设置空白对照、单染对照及阴性对照
- 洗涤与重悬
染色完成后用流式缓冲液(如PBS+1%FBS)洗涤1–2次,去除多余抗体。
离心速度一般为300–400 g,时间3–5分钟
最终将细胞重悬在适量缓冲液中,准备上机
- 上机检测
将样本上机后,使用流式细胞仪读取数据。每次检测建议收集10,000\~100,000个细胞,以确保统计学意义。
四、流式抗体选择与配色建议
多色流式实验需要仔细设计panel(抗体组合),以避免荧光染料间的光谱重叠。以下是设计原则:
高表达抗原→弱荧光染料(如FITC)
低表达抗原→强荧光染料(如PE, APC)
避免使用光谱重叠严重的组合,如PE与PE-Texas Red
此外,不同仪器支持的激光通道数量不同(3色、8色甚至30色),设计panel时要依据仪器参数合理搭配。
五、数据分析流程简介
流式数据通过专用软件如FlowJo、FCS Express进行分析。分析步骤一般包括:
- 细胞群体识别(Gate):使用FSC/SSC排除碎片和聚集细胞
- 去除死细胞:使用PI或Zombie染料排除非活细胞
- 设定阴性/阳性门限:依据单染样本设置Gate判断阳性表达
- 输出结果图与表格:直方图、点图、频率统计等
对照样本(如同型对照、阴性对照)在分析中非常关键,用于判断特异性表达信号。
六、新手常见错误与解决方法
| 错误 | 原因分析 | 解决建议 |
| 背景信号高 | 抗体浓度过高、未洗净 | 稀释抗体、增加洗涤 |
| 点图模糊不清 | 荧光补偿错误 | 使用单染样本重新设定补偿 |
| 无明显分群 | 抗体失效或标记物表达低 | 更换抗体或使用更亮的荧光染料 |
| 上机堵管 | 样本团聚 | 加过滤步骤,确保单细胞 |
七、新手如何快速入门?
多做基础染色练习:如单抗染色、死活染色
参与他人实验操作:实地观察他人染色流程与数据分析
阅读经典文献与厂商说明书:提升实验设计能力
记录每次实验参数与效果:为panel优化积累经验
八、结语
掌握流式细胞术并不难,关键在于理解其背后的原理、规范的操作流程以及严谨的对照设置。作为一项高通量、精确且功能强大的分析工具,流式技术将为你的课题研究打开全新的思路。
如果你刚进入实验室,流式细胞术绝对是你不可忽视的一项核心技能。通过持续练习和经验积累,你也可以从一个“按钮操作员”成长为真正的“数据解读者”。
