突破!功能性血管网络皮肤类器官问世,为炎症性皮肤病建模提供新工具
在皮肤病研究领域,“如何构建更贴近人体真实皮肤的模型” 一直是科研人员攻关的核心方向。近日,围绕 “具有功能性血管网络的皮肤类器官” 的研究取得关键进展 —— 这项技术不仅解决了传统皮肤类器官 “缺乏血管支撑” 的痛点,更让炎症性皮肤病(如银屑病、特应性皮炎)的精准建模成为可能,为疾病机制研究和药物筛选打开新窗口。
一、为什么要 “给皮肤类器官装血管”?
皮肤类器官是通过干细胞诱导分化形成的三维结构,能模拟人体皮肤的表皮、真皮分层及毛囊、皮脂腺等附属结构,已成为皮肤病研究的重要工具。但传统皮肤类器官缺乏功能性血管网络,存在两大关键问题:
营养供应不足:类器官体积增大后,内部细胞因无法获取充足氧气和营养而坏死,难以模拟人体皮肤的完整生理功能;
无法模拟炎症反应的 “血管参与过程”:炎症性皮肤病的发病(如银屑病的红斑、水肿)与血管异常增生、免疫细胞通过血管浸润密切相关,无血管的类器官无法还原这一核心病理环节。
因此,构建 “带血管” 的功能性皮肤类器官,成为突破现有研究瓶颈的关键。
二、功能性血管网络如何 “嵌入” 皮肤类器官?
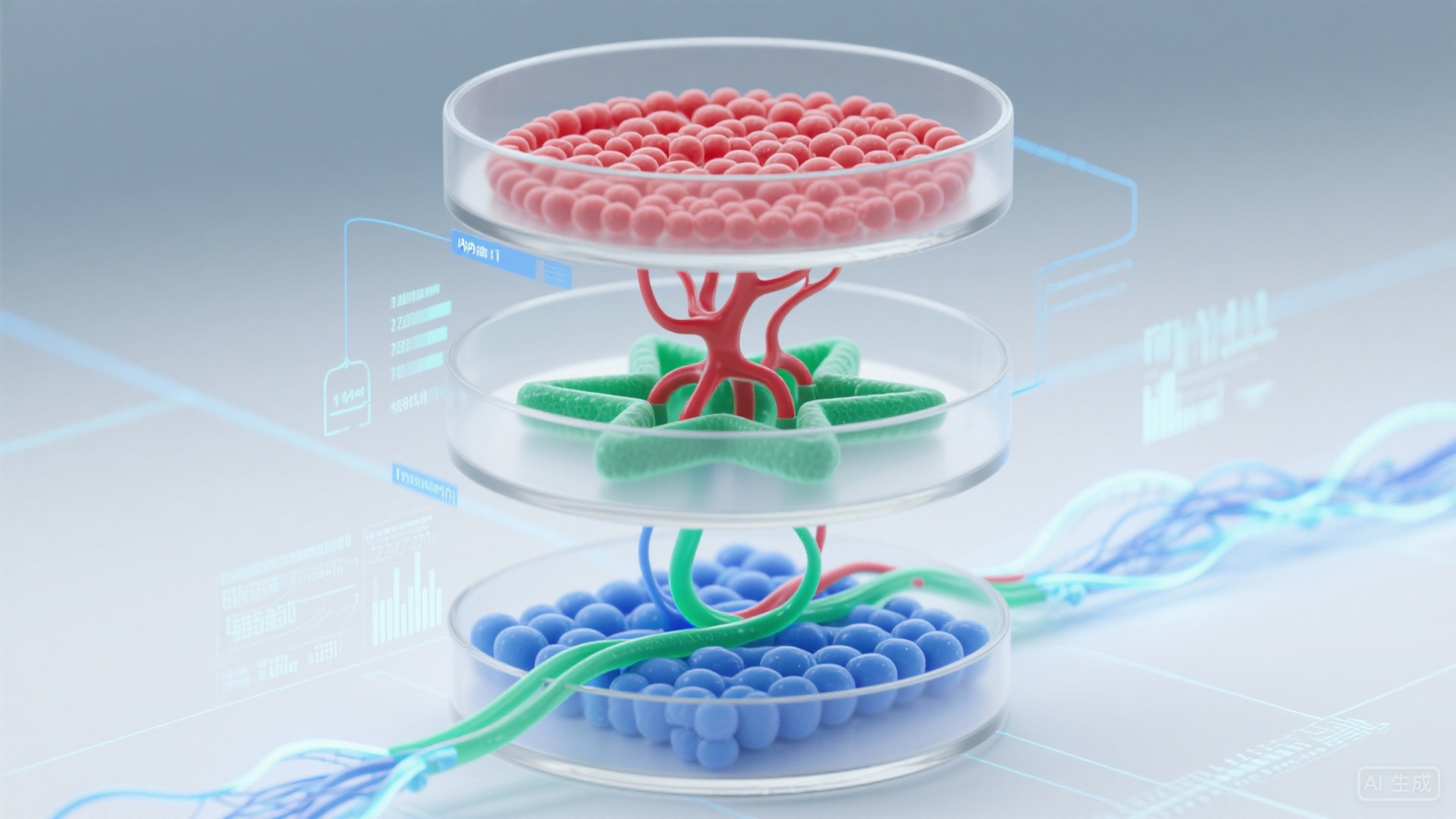
目前主流的构建技术基于 “多细胞共培养” 和 “仿生微环境诱导”,核心步骤可概括为 3 点:
细胞来源选择:采用诱导多能干细胞(iPSC)分化为皮肤细胞(角质形成细胞、成纤维细胞)和血管细胞(内皮细胞、周细胞),确保细胞来源的一致性和安全性;
三维支架搭建:使用胶原蛋白、基质胶等仿生材料构建支架,为皮肤细胞分层生长和血管形成提供 “支撑框架”;
血管功能诱导:通过添加血管内皮生长因子(VEGF)、成纤维细胞生长因子(FGF)等细胞因子,诱导内皮细胞形成管状结构,并与周细胞结合形成稳定的血管网络 —— 最终形成的血管不仅能 “输送营养”,还能与皮肤细胞形成功能连接,模拟人体皮肤的血管 – 组织交互作用。
据相关研究数据,这种方法构建的血管网络在体外培养 2-3 周后,血管通畅率可达 85% 以上,且能响应炎症信号(如 LPS 刺激后,血管通透性会显著增加,模拟炎症状态下的血管反应)。
三、它如何助力炎症性皮肤病建模?
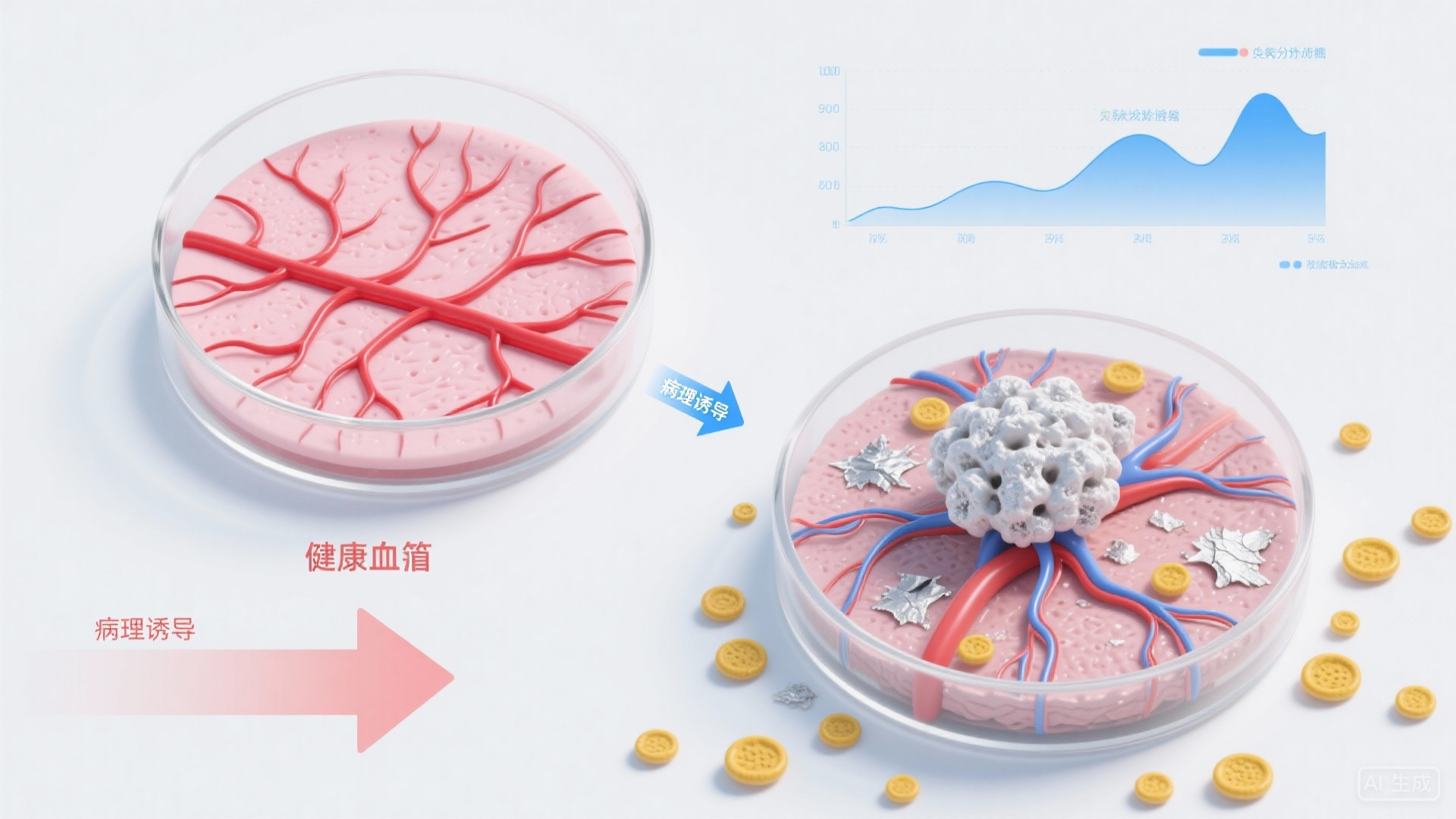
以银屑病(俗称 “牛皮癣”)和特应性皮炎(湿疹)这两种高发炎症性皮肤病为例,功能性血管皮肤类器官的应用展现出独特优势:
- 还原疾病的 “血管病理特征”
银屑病患者皮肤存在血管异常增生、血管内皮细胞活化等问题;传统类器官无法模拟这一现象,而带血管的类器官可通过诱导血管内皮细胞表达炎症相关分子(如 ICAM-1、VCAM-1),还原 “血管增生 – 免疫细胞浸润” 的病理链条;
研究人员将银屑病患者的 iPSC 分化为皮肤 – 血管类器官后,成功观察到与患者皮肤相似的 “角质形成细胞过度增殖”“血管扩张” 等特征,为研究疾病起源提供了更精准的模型。
- 提升药物筛选的 “临床相关性”
以往基于传统类器官或动物模型的药物筛选,常因 “模型与人体差异大” 导致候选药物在临床实验中失败。而功能性血管皮肤类器官能:
模拟药物在人体皮肤中的 “血管吸收过程”,更准确评估药物的渗透效率;
观察药物对 “血管 – 皮肤交互作用” 的影响,例如某款银屑病候选药物可通过抑制血管内皮生长因子(VEGF),减少类器官中的血管增生,同时降低角质形成细胞的过度增殖 —— 这一结果与临床患者的治疗反应高度一致,大幅提升了药物筛选的可靠性。
四、未来展望:从 “实验室” 走向 “临床应用”
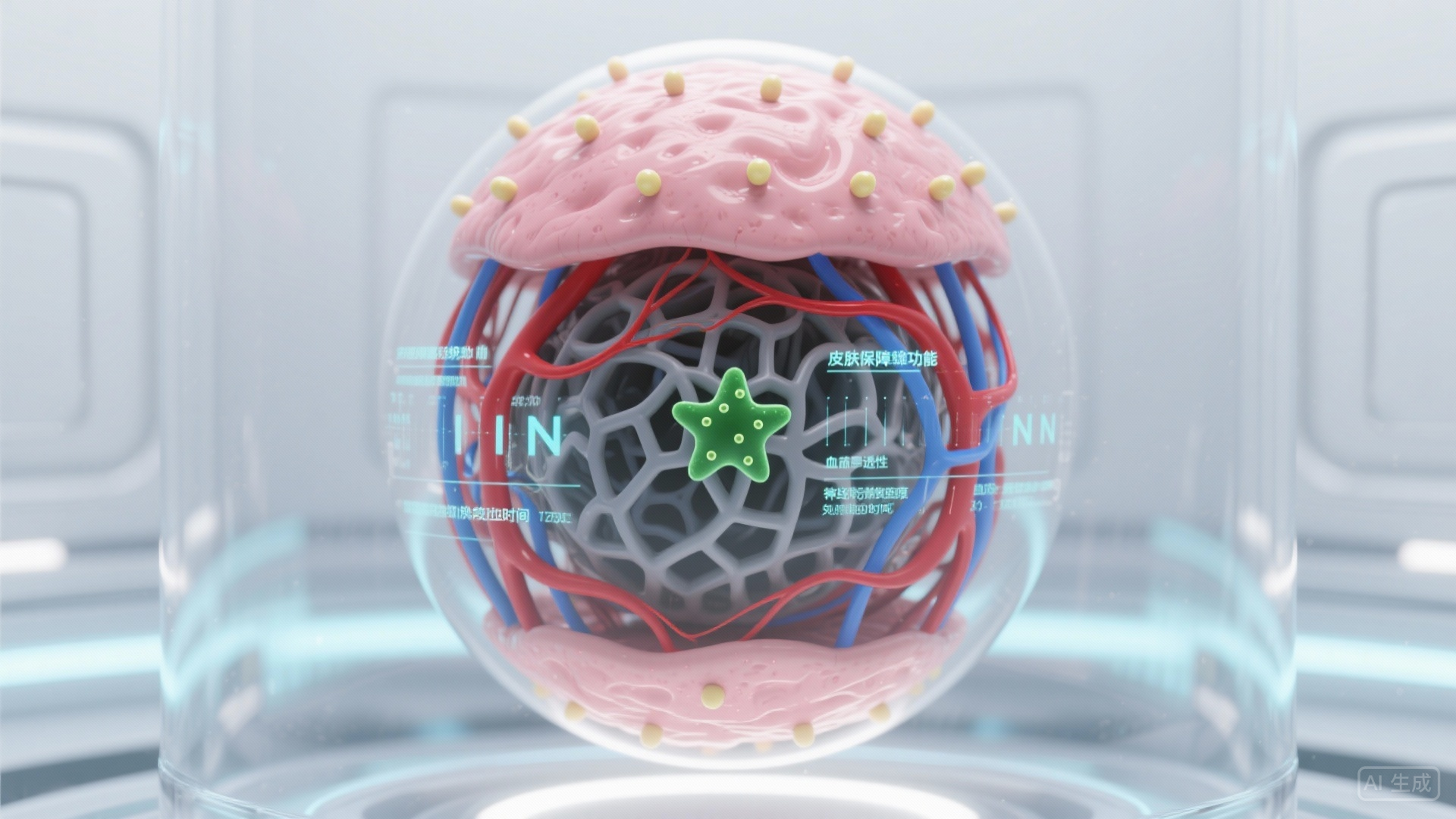
目前,功能性血管皮肤类器官的研究仍处于快速发展阶段,未来将向三个方向突破:
模型精细化:进一步加入神经细胞、免疫细胞(如 T 细胞、巨噬细胞),构建 “皮肤 – 血管 – 神经 – 免疫” 多系统协同的类器官,更全面模拟皮肤病的复杂病理机制;
个性化建模:利用患者自身 iPSC 构建专属类器官,实现 “一人一模型”,为炎症性皮肤病的精准诊断和个性化治疗方案制定提供支持;
产业化应用:探索规模化培养技术,降低类器官制备成本,推动其在药物研发、化妆品安全性评价等领域的产业化落地。
这项研究不仅是皮肤类器官技术的一次重要突破,更让我们看到 “类器官模型” 从 “模拟结构” 向 “模拟功能” 的跨越。随着技术的成熟,未来或许能通过患者专属的皮肤类器官,提前预测治疗效果、减少试药风险 —— 这对 millions 炎症性皮肤病患者而言,无疑是新的希望。
