解锁基因调控研究 “神器”:双荧光素酶报告实验全攻略
在分子生物学研究领域,基因表达调控机制的探索始终是核心课题。无论是研究转录因子与靶基因的相互作用,还是验证 microRNA 对靶 mRNA 的调控关系,都需要精准、可靠的实验技术作为支撑。而双荧光素酶报告实验,正是凭借其高灵敏度、强特异性和良好重复性,成为了基因调控研究中的 “明星技术”。今天,我们就带大家全面解锁这项实验技术,从原理到操作,从常见问题到应用案例,手把手教你玩转双荧光素酶报告实验。
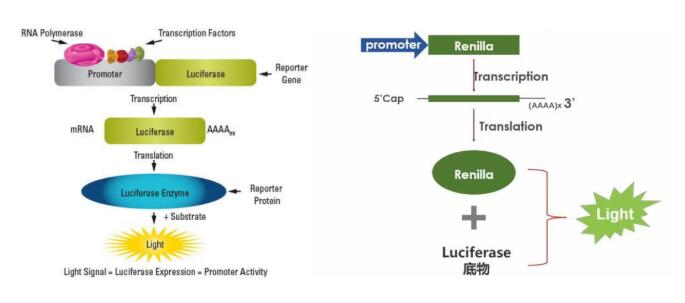
一、什么是双荧光素酶报告实验?一句话看懂核心原理
要理解双荧光素酶报告实验,首先得从 “荧光素酶报告基因” 说起。荧光素酶是一类能催化荧光素发光的酶,其催化产生的发光强度与酶的活性直接相关,而酶的活性又由其编码基因(报告基因)的表达水平决定。因此,通过检测发光强度,就能间接反映报告基因的表达情况,进而推断调控元件(如启动子、增强子、microRNA 结合位点等)的活性。
但普通的单荧光素酶报告实验,往往会受到细胞转染效率、细胞状态差异、试剂批次误差等因素的干扰,导致实验结果不够准确。而双荧光素酶报告实验的核心创新,就在于引入了 “内参荧光素酶”,形成 “报告荧光素酶 + 内参荧光素酶” 的双报告系统,从而有效排除干扰,让结果更可信。
简单来说,实验原理可以概括为三步:
- 构建双报告载体:将目标调控元件(如含有转录因子结合位点的启动子片段、含有 microRNA 结合位点的 3’UTR 片段)插入到 “报告荧光素酶”(常用萤火虫荧光素酶,Firefly Luciferase)的上游或下游,同时将另一种 “内参荧光素酶”(常用海肾荧光素酶,Renilla Luciferase)构建到同一载体中,作为内参对照。
- 共转染细胞:将构建好的双报告载体与待研究的调控因子(如转录因子表达质粒、microRNA 模拟物 / 抑制剂)共转染到目标细胞中,培养一定时间,让调控因子与报告载体充分作用。
- 检测发光强度:使用双荧光素酶检测试剂盒,依次加入报告荧光素酶底物和内参荧光素酶底物,分别检测两种酶的发光强度(记为 Firefly LUC 值和 Renilla LUC 值)。最终以Firefly LUC 值 / Renilla LUC 值的比值作为实验结果,该比值能有效消除转染效率、细胞数量、操作误差等因素的影响,真实反映调控因子对目标元件的调控作用。
二、为什么选择双荧光素酶报告实验?这 3 大优势无可替代
在基因调控研究中,可选择的实验技术并不少,比如凝胶迁移实验(EMSA)、染色质免疫沉淀实验(ChIP)、实时荧光定量 PCR(qPCR)等,但双荧光素酶报告实验凭借其独特优势,成为了许多研究者的首选,尤其是在 “体内验证调控关系” 方面,几乎无可替代。
优势 1:高灵敏度,可检测微弱调控信号
荧光素酶的催化发光反应具有极高的灵敏度,其检测下限可达到 10^-20 mol 级别,远高于放射性同位素标记和荧光蛋白检测。这意味着即使调控因子对目标元件的调控作用非常微弱(如仅引起报告基因表达水平 1.5 倍的变化),双荧光素酶报告实验也能准确检测到,避免了因信号过弱而遗漏重要调控关系的问题。
例如,在研究某些弱启动子的活性时,qPCR 可能因目的基因表达量过低而无法准确定量,而双荧光素酶报告实验通过检测发光信号,能轻松捕捉到启动子活性的细微变化,为研究弱调控机制提供了可能。
优势 2:强特异性,排除非特异性干扰
双荧光素酶报告实验的特异性主要体现在两个方面:一是报告基因本身不具有物种特异性,不会与宿主细胞的内源性基因发生交叉反应;二是 “内参校正” 机制能有效排除非特异性干扰。
在实验中,细胞转染效率的差异(如不同孔的细胞转染载体数量不同)、细胞状态的波动(如部分细胞因营养不足导致活性下降)、试剂添加量的微小误差等,都可能影响报告荧光素酶的发光强度。而内参荧光素酶的表达不受目标调控因子的影响,其发光强度能反映转染效率和细胞活性的真实情况。通过计算两者的比值,就能将这些非特异性干扰因素的影响降至最低,让实验结果更具说服力。
优势 3:操作简便,实验周期短
相比于 ChIP、EMSA 等需要复杂样品处理(如染色质提取、蛋白纯化)的实验,双荧光素酶报告实验的操作流程更为简便。从载体构建到发光检测,整个实验周期通常只需 3-5 天(载体构建 1-2 天,细胞转染与培养 1-2 天,检测 1 天),大大缩短了研究周期。
同时,市面上的双荧光素酶检测试剂盒已相当成熟,多数试剂盒采用 “一步法” 检测(即加入底物后直接读数),无需复杂的样品预处理,普通实验室人员经过简单培训就能熟练操作,降低了实验技术门槛。
三、实验操作全流程:从载体构建到结果分析,每一步都关键
双荧光素酶报告实验的操作看似简单,但要得到理想的实验结果,每一个步骤都需要严格把控。下面我们就以 “验证转录因子 A 对基因 B 启动子的调控作用” 为例,详细拆解实验的关键操作步骤。
步骤 1:载体构建 —— 实验成功的 “基石”
载体构建是双荧光素酶报告实验的第一步,也是最关键的一步。如果报告载体构建失败(如目的片段插入方向错误、出现碱基突变),后续实验再完美也无法得到正确结果。
关键操作要点:
- 选择合适的双报告载体骨架:常用的商业化双报告载体有 pGL4 系列(Promega 公司)、psiCHECK 系列(Promega 公司)等,这些载体已预先构建好萤火虫荧光素酶基因(如 hLuc+)和海肾荧光素酶基因(如 hRluc),研究者只需将目标调控元件(如基因 B 的启动子片段)插入到报告荧光素酶基因的上游多克隆位点即可。
- 准确扩增目的片段:根据基因 B 启动子的序列,设计带有酶切位点的特异性引物,通过 PCR 扩增目的片段。扩增后需进行琼脂糖凝胶电泳验证,确保片段大小正确,且无杂带。
- 酶切与连接:使用与引物设计一致的限制性内切酶,分别对目的片段和双报告载体进行酶切,酶切后回收纯化片段和载体,再用 T4 DNA 连接酶将目的片段与载体连接,构建成重组双报告载体。
- 载体验证:连接产物转化大肠杆菌感受态细胞,挑取单克隆菌落进行培养,提取质粒后通过酶切鉴定和测序验证,确保目的片段正确插入载体,且无碱基突变。
步骤 2:细胞转染 —— 控制误差的 “关键环节”
细胞转染的效率直接影响实验结果的重复性,因此需要严格控制转染条件,确保每组实验的转染效率一致。
关键操作要点:
- 选择合适的细胞系:应选择与研究背景相符的细胞系(如研究人类基因调控,优先选择人源细胞系 HEK293T、HeLa 等),且细胞状态良好(贴壁牢固、形态规则、无支原体污染)。转染前 1 天,将细胞接种到 96 孔板或 24 孔板中,确保转染时细胞密度达到 70%-80%(密度过高或过低都会影响转染效率)。
- 确定最佳转染试剂与剂量:不同细胞系对转染试剂的敏感性不同,需提前进行预实验,筛选出适合目标细胞的转染试剂(如 Lipofectamine 3000、Polyjet 等)及其最佳使用剂量(通常转染试剂与质粒的质量比为 2:1-4:1)。
- 严格控制转染体系:每组实验设置 3 个复孔(减少随机误差),同时设置阴性对照(如转染空载体)和阳性对照(如转染已知能激活该启动子的转录因子质粒)。转染时,将重组双报告载体、转录因子表达质粒(或对照质粒)与转染试剂按照比例混合,室温孵育 15-20 分钟后,均匀滴加到细胞孔中,轻轻摇匀。
- 转染后培养:转染完成后,将细胞放入 37℃、5% CO2 培养箱中培养 24-48 小时(具体时间根据细胞类型和调控因子的作用时间调整,避免培养时间过长导致细胞过度生长)。
步骤 3:发光检测 —— 数据准确的 “最后防线”
发光检测是获取实验数据的最后一步,操作时需严格按照试剂盒说明书进行,避免因操作不当导致数据偏差。
关键操作要点:
- 样品制备:培养结束后,吸弃细胞培养液,用 PBS 轻轻洗涤细胞 1-2 次(避免残留培养液影响检测),然后加入适量的细胞裂解液(如 Passive Lysis Buffer),室温裂解 15-20 分钟,期间可轻轻摇晃培养板,确保细胞充分裂解。
- 发光检测:将裂解液转移到白色不透光的 96 孔检测板中(白色板能减少光反射,提高检测灵敏度),每孔加入 50μL 报告荧光素酶底物(如 Luciferase Assay Reagent),轻轻混匀后,立即放入荧光素酶检测仪中检测 Firefly LUC 值;随后每孔加入 50μL 内参荧光素酶底物(如 Stop & Glo Reagent,能终止报告酶反应并启动内参酶反应),再次检测 Renilla LUC 值。
- 数据记录与分析:记录每组实验的 Firefly LUC 值和 Renilla LUC 值,计算每组的比值(Firefly/Re nilla),然后用 GraphPad Prism 等软件进行统计分析,绘制柱状图并进行显著性检验(通常 P<0.05 为差异显著)。
四、避坑指南:这 5 个常见问题,90% 的人都踩过
尽管双荧光素酶报告实验操作相对简便,但在实际操作中,很多研究者仍会遇到各种问题,导致实验结果不理想。下面我们就总结 5 个最常见的问题,并给出对应的解决方案,帮你轻松避坑。
问题 1:发光值过低,甚至检测不到信号
可能原因:① 载体构建失败(如目的片段未插入、报告基因发生突变);② 细胞转染效率过低;③ 裂解液用量不足,细胞裂解不充分;④ 底物失效(荧光素酶底物需避光保存,且有效期较短)。
解决方案:① 重新验证载体(酶切 + 测序),确保载体构建正确;② 优化转染条件(更换转染试剂、调整质粒与转染试剂比例、确保细胞状态良好);③ 增加裂解液用量,延长裂解时间,必要时使用振荡器辅助裂解;④ 检查底物是否在有效期内,使用前恢复至室温,避免反复冻融。
问题 2:内参值差异过大,无法校正
可能原因:① 转染操作不规范(如加样时移液器误差过大、混合不均匀);② 细胞接种密度不一致;③ 内参基因受到调控因子的影响(如选择的内参启动子与调控因子存在相互作用)。
解决方案:① 严格规范转染操作,使用量程合适的移液器,加样后轻轻摇晃培养板;② 接种细胞时确保每孔细胞数量一致,可使用细胞计数仪计数;③ 选择不受调控因子影响的内参启动子(如 CMV 启动子、TK 启动子),避免内参基因被调控。
问题 3:实验组与对照组无差异,无法验证调控关系
可能原因:① 调控元件片段长度不合适(如未包含关键的结合位点、片段过长导致空间位阻);② 调控因子表达量过低(如表达质粒启动子活性弱、转染效率低);③ 实验条件不合适(如培养时间过短、细胞系选择不当)。
解决方案:① 重新设计调控元件片段,确保包含关键结合位点(可通过生物信息学软件预测结合位点,如 JASPAR、TargetScan);② 更换强启动子的表达质粒(如 CMV 启动子),提高调控因子的表达量;③ 延长培养时间(如从 24 小时延长至 48 小时),更换与研究背景更相符的细胞系。
问题 4:重复性差,不同批次实验结果差异大
可能原因:① 细胞状态不稳定(如细胞传代次数过多、存在支原体污染);② 试剂批次差异(如转染试剂、底物批次不同);③ 操作步骤不统一(如裂解时间、检测时间不一致)。
解决方案:① 定期冻存细胞,避免传代次数过多,使用支原体检测试剂盒排查污染;② 尽量使用同一批次的试剂,若更换批次需重新进行预实验;③ 制定标准化的操作流程,严格控制每一步的时间和条件(如裂解时间固定为 20 分钟、检测时每孔反应时间一致)。
问题 5:背景值过高,影响信号检测
可能原因:① 载体本身存在泄漏表达(如报告基因启动子在无调控因子时仍有较高活性);② 细胞裂解液中存在杂质,干扰发光反应;③ 检测仪器灵敏度过高,检测到非特异性信号。
解决方案:① 选择泄漏表达低的载体骨架(如 pGL4.10 载体,其基础活性较低),或在载体中加入绝缘子序列,减少泄漏表达;② 裂解后离心去除细胞碎片(如 12000rpm 离心 5 分钟),取上清进行检测;③ 调整检测仪器的灵敏度,设置合适的检测阈值,排除非特异性信号。
五、应用案例:双荧光素酶报告实验的 “用武之地”
双荧光素酶报告实验的应用场景非常广泛,几乎涵盖了基因调控研究的各个领域。下面我们通过两个典型案例,看看这项技术是如何助力科研的。
案例 1:验证转录因子对靶基因启动子的激活作用
研究背景:研究者发现转录因子 NF-κB 在炎症反应中高表达,且通过生物信息学预测,NF-κB 可能结合到炎症相关基因 IL-6 的启动子区域,调控 IL-6 的表达。为验证这一调控关系,研究者采用双荧光素酶报告实验。
实验设计:① 构建重组双报告载体:将 IL-6 启动子片段插入 pGL4.10 载体(报告基因:萤火虫荧光素酶),内参基因为海肾荧光素酶(pGL4.74 载体);② 分组:实验组(转染 IL-6 启动子报告载体 + NF-κB 表达质粒)、对照组(转染 IL-6 启动子报告载体 + 空载体);③ 转染 HEK293T 细胞,培养 24 小时后检测发光值。
实验结果:实验组的 Firefly/Renilla 比值显著高于对照组(P<0.01),表明 NF-κB 能激活 IL-6 启动子的活性,进而促进 IL-6 的表达,验证了两者的调控关系。
案例 2:验证 microRNA 对靶 mRNA 的抑制作用
研究背景:研究者通过 TargetScan 预测,microRNA-124 可能结合到肿瘤相关基因 MMP9 的 3’UTR 区域,抑制 MMP9 的表达。为验证这一预测,采用双荧光素酶报告实验。
实验设计:① 构建重组双报告载体:将 MMP9 的 3’UTR 片段插入 psiCHECK-2 载体(报告基因:海肾荧光素酶,内参基因:萤火虫荧光素酶);② 分组:实验组(转染 MMP9 3’UTR 报告载体 + miR-124 模拟物)、对照组(转染 MMP9 3’UTR 报告载体 + 阴性对照模拟物);③ 转染 A549 细胞,培养 48 小时后检测发光值。
实验结果:实验组的 Renilla/Firefly 比值显著低于对照组(P<0.01),表明 miR-124 能通过结合 MMP9 的 3’UTR 区域,抑制 MMP9 的表达,证实了两者的靶向调控关系。
六、总结:从基础研究到临床应用,双荧光素酶报告实验未来可期
双荧光素酶报告实验作为一项成熟的基因调控研究技术,不仅在基础研究中发挥着重要作用(如解析转录调控网络、鉴定 microRNA 靶基因、筛选药物作用靶点等),还在临床应用领域展现出巨大潜力。例如,在肿瘤研究中,可利用该技术构建肿瘤相关基因的报告载体,筛选能抑制肿瘤基因表达的药物;在病毒研究中,可通过检测病毒启动子的活性,评估抗病毒药物的疗效。
当然,随着技术的不断发展,双荧光素酶报告实验也在不断升级,如与高通量筛选技术结合,实现大规模调控因子的筛选;与活细胞成像技术结合,实时监测基因调控的动态过程。相信在未来,这项技术将为基因调控研究和疾病治疗带来更多新的突破。
如果你在实验过程中遇到了问题,或者有更多关于双荧光素酶报告实验的疑问,欢迎在评论区留言,我们一起交流探讨,让科研之路更顺畅!
