解密 STING 转位:细胞内的 “信号快递员” 如何影响健康与疾病?
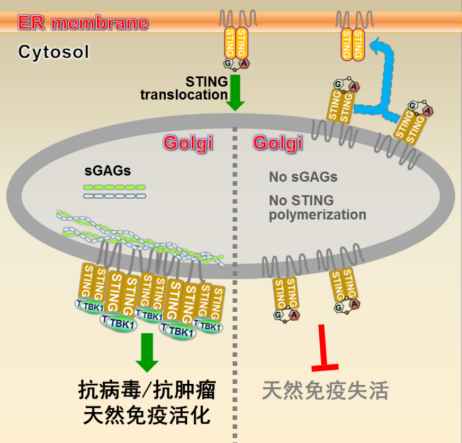 图1 硫酸化糖胺聚糖是STING共配体及STING转位至高尔基体活化的原因(图片来源于百度)
图1 硫酸化糖胺聚糖是STING共配体及STING转位至高尔基体活化的原因(图片来源于百度)
提到人体的免疫防御系统,我们通常会想到白细胞、抗体这些 “冲锋陷阵” 的 “战士”。但在细胞内部,还有一套精密的 “信号传递网络”,它们如同 “情报员”,一旦发现外来入侵(如病毒、细菌)或内部异常(如基因突变),就会迅速启动防御机制。而 STING 蛋白,正是这套网络中至关重要的 “信号枢纽”—— 更关键的是,它的 “工作地点” 会随任务需求发生动态变化,这一过程被称为STING 转位,近期已成为免疫学和医学研究的热点。
今天,我们就来揭开 STING 转位的神秘面纱:它是什么?如何发生?又对人类健康意味着什么?
一、先搞懂:STING 是谁?为什么 “转位” 很重要?
STING 的全称是 “干扰素基因刺激蛋白”(Stimulator of Interferon Genes),1998 年首次被科学家发现。它原本 “定居” 在细胞的内质网(一种负责蛋白质合成和加工的细胞器)上,就像一个 “值班哨兵”,时刻监测细胞内是否出现 “异常信号”—— 尤其是病原体的 “核酸碎片”(如病毒的 DNA、细菌的环状 DNA)或细胞自身受损后释放的 “DNA 垃圾”。
当 STING 捕捉到这些 “危险信号” 后,它不会一直待在内质网里 “发号施令”,而是会启动一段 “长途旅行”:从内质网出发,经过高尔基体(细胞内的 “物流中转站”),最终到达核内体或溶酶体(负责物质降解的 “回收站”)。这一从 “起点” 到 “终点” 的位置变化,就是STING 转位。
为什么 “转位” 如此关键?研究发现,STING 只有在转位过程中,才能完成自身的 “激活”—— 就像快递员只有把包裹送到指定地点,才能触发后续的 “签收” 和 “反馈”。如果 STING 转位出现异常,要么会导致免疫反应 “过度激活”(攻击自身细胞),要么会导致免疫反应 “失灵”(无法对抗病原体或癌细胞),进而引发多种疾病。
二、深度解析:STING 转位的 “三步曲” 与调控密码
STING 的转位过程并非 “随机游走”,而是由一系列精密的分子机制调控,目前科学家已明确其核心的 “三步曲”:
第一步:内质网 “启动”—— 信号触发构象变化
正常情况下,STING 在内质网上处于 “休眠状态”,其 N 端和 C 端的结构域相互折叠,掩盖了关键的 “活性位点”。当细胞内出现 “异常核酸”(如病毒 DNA)时,会先被一种名为 “cGAS” 的蛋白识别 ——cGAS 会激活并产生一种名为 “cGAMP” 的小分子信号。
cGAMP 会与 STING 的 C 端结构域结合,触发 STING 发生构象变化:原本折叠的结构被 “打开”,暴露出内质网上的 “转运信号”(一种名为 “ER export motif” 的氨基酸序列)。此时,STING 会与内质网上的 “转运蛋白”(如 Sec23/24 复合物)结合,准备离开内质网。
第二步:高尔基体 “加工”—— 磷酸化激活信号通路
离开内质网后,STING 会通过 “囊泡运输” 到达高尔基体。在高尔基体上,STING 会遇到关键的 “激酶”(如 TBK1 激酶)——TBK1 会给 STING 的特定氨基酸位点 “添加磷酸基团”(这一过程称为 “磷酸化”)。
磷酸化后的 STING 会发生进一步的构象变化,形成 “二聚体”(两个 STING 分子结合在一起),并招募另一种名为 “IRF3” 的转录因子。IRF3 被激活后,会进入细胞核,启动 “干扰素” 等免疫相关基因的表达 —— 干扰素就像 “警报信号”,会通知周围的细胞启动抗病毒防御。
第三步:核内体 / 溶酶体 “终止”—— 降解避免过度激活
免疫反应启动后,STING 并不会一直 “活跃”,否则会导致免疫过度。因此,完成信号传递的 STING 会被转运到核内体或溶酶体中,通过 “泛素化”(添加泛素分子标记)被识别并降解 —— 这一过程就像 “任务完成后回收快递盒”,确保免疫反应在 “有效防御” 和 “避免损伤” 之间达到平衡。
值得注意的是,STING 的转位每一步都有 “调控密码”:比如内质网的 “转运信号” 需要与特定蛋白结合才能启动;高尔基体的磷酸化需要 TBK1 激酶的精准 “定位”;溶酶体的降解则依赖于泛素化酶的调控。任何一步的 “密码错乱”,都会导致 STING 转位异常。
三、临床关联:STING 转位异常与疾病的 “爱恨情仇”
随着研究的深入,科学家发现 STING 转位与多种疾病密切相关,这也让它成为潜在的 “药物靶点”:
- 感染性疾病:转位失灵,免疫 “失守”
当病毒(如新冠病毒、疱疹病毒)入侵细胞时,会通过多种手段 “干扰 STING 转位”:比如新冠病毒的 “ORF3a” 蛋白会阻止 STING 从内质网向高尔基体转运,导致干扰素无法产生,病毒得以 “逃避免疫攻击”。
反过来,如果能通过药物 “修复 STING 转位”,就能恢复免疫反应,帮助身体对抗病毒。目前已有研究团队在动物实验中证实,通过激活 STING 转位,可显著增强小鼠对流感病毒、新冠病毒的抵抗力。
- 自身免疫病:转位过度,免疫 “自噬”
如果 STING 转位不受控制,会导致免疫反应过度激活,攻击自身组织。比如 “系统性红斑狼疮”(SLE)患者的细胞中,由于 DNA 降解机制异常,大量自身 DNA 碎片会激活 cGAS-STING 通路,导致 STING 持续转位并产生过量干扰素,进而引发关节炎症、皮肤红斑等症状。
此外,“干燥综合征”“类风湿关节炎” 等自身免疫病中,也发现 STING 转位异常的痕迹。针对这些疾病,科学家正在研发 “STING 转位抑制剂”,通过阻止 STING 过度激活,缓解免疫损伤。
- 癌症:转位不足,免疫 “沉默”
癌细胞为了 “躲避免疫系统的追杀”,会通过多种方式抑制 STING 转位:比如某些肺癌、结肠癌的癌细胞会降低 STING 的表达量,或通过基因突变导致 STING 无法正常转位,进而无法启动抗肿瘤免疫反应。
针对这一问题,目前全球已有多款 “STING 激动剂” 进入临床试验 —— 这些药物能模拟 cGAMP 的作用,激活 STING 并促进其转位,从而 “唤醒” 免疫系统对癌细胞的攻击。2023 年《自然・医学》杂志发表的研究显示,一款 STING 激动剂联合 PD-1 抑制剂(免疫检查点药物),对晚期黑色素瘤的有效率提升了 30% 以上。
四、未来展望:STING 转位研究如何改变临床治疗?
目前,STING 转位的研究仍在快速推进,科学家们正在攻克两大核心问题:
一是精准调控:如何通过药物 “精准控制” STING 转位的程度和时长 —— 既不让免疫反应 “不足”,也不让其 “过度”。比如针对自身免疫病,研发 “选择性抑制 STING 转位” 的药物;针对癌症,研发 “靶向激活肿瘤微环境中 STING 转位” 的药物(避免全身免疫激活带来的副作用)。
二是机制深挖:目前对 STING 转位的调控机制仍有很多未知 —— 比如不同细胞类型中 STING 转位的差异、衰老细胞中 STING 转位的变化等。这些问题的解决,将为更多疾病(如神经退行性疾病、衰老相关疾病)的治疗提供新思路。
正如哈佛大学免疫学教授 Arlene Sharpe 所说:“STING 转位就像细胞内的‘信号快递系统’,一旦我们掌握了它的‘运行规则’,就能通过‘调控快递路线’来治疗疾病。” 未来,随着研究的深入,STING 转位有望成为连接免疫学、细胞生物学和临床医学的 “桥梁”,为更多患者带来新的治疗希望。
