🧬微生物基因组DNA提取全攻略:从样本处理到试剂盒选择
“DNA提取是分子生物学的第一步,也是决定实验成功的关键一步。”
无论你是刚入门的科研小白,还是资深的微生物学研究者,都无法绕开一个核心环节——基因组DNA的提取。
今天这篇推文,就带你从样本前处理、提取原理、常见难点、到试剂盒选择,系统了解微生物基因组DNA提取的全流程,让你的实验从源头就稳如泰山。
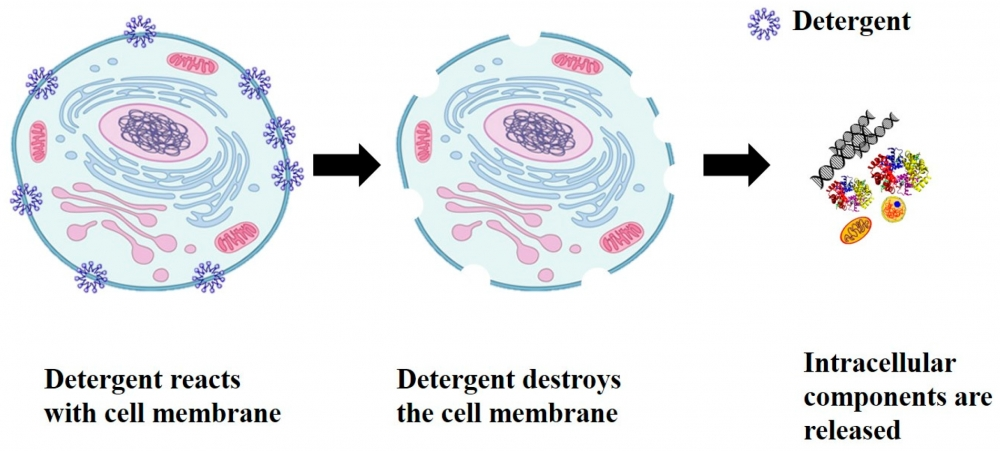
一、为什么要提取微生物基因组DNA?
微生物基因组DNA(Genomic DNA, gDNA)是后续分子实验的基础原料,包括:
- 🧫物种鉴定(如16S rRNA测序、ITS测序)
- 🧪功能基因检测(如耐药基因、毒力基因筛查)
- 🔬宏基因组学分析(Metagenomics)
- 🧬全基因组测序(WGS)或重测序
高质量的DNA不仅影响扩增效率和测序数据质量,还会影响后续的生信分析结果。
因此,一份纯度高、完整性好的DNA,是一切下游实验的“灵魂”。
二、样本类型与前处理策略
不同类型的微生物样本差异极大,DNA提取的难点也各不相同。以下是常见样本类型及处理要点👇:
| 样本类型 | 特点 | 关键前处理方法 |
| 细菌培养物 | 细胞壁坚固(尤其是革兰阳性菌) | 采用溶菌酶预处理或机械破碎(珠磨) |
| 真菌/酵母 | 含几丁质细胞壁 | 用酶解液(Zymolyase/Lyticase)或液氮研磨 |
| 土壤样本 | 有机物多,抑制剂丰富 | 加入PVPP或CTAB吸附抑制物,充分洗涤 |
| 粪便样本 | 菌群复杂,脂多糖含量高 | 使用专用微生物组试剂盒,高效裂解+去杂 |
| 环境样本(如水样) | 细胞量低 | 先滤膜富集,再提取DNA |
⚠️小贴士:样本保存不当是DNA降解的主要原因。
建议在−80°C长期保存前,先加入DNA稳定剂或快速冻存,避免反复冻融。
三、DNA提取的核心原理
无论是人工方法还是商业试剂盒,DNA提取的核心思路都可以概括为“四步走”:
1️⃣ 细胞裂解
目标:破坏细胞壁/膜,释放DNA。
常用方法:
- 化学裂解(SDS、CTAB)
- 酶学裂解(溶菌酶、蛋白酶K)
- 物理裂解(珠磨、超声波、冻融循环)
2️⃣ 去除蛋白质与杂质
- 酚/氯仿抽提法:经典而有效,但有毒且操作繁琐。
- 硅胶膜吸附法:现代主流,快速、安全、适合高通量。
- 磁珠法:自动化友好,适合宏基因组样本处理。
3️⃣ DNA沉淀与纯化
通常采用异丙醇或乙醇沉淀,再经70%乙醇洗涤去盐。
4️⃣ DNA溶解与保存
最终产物溶解于TE缓冲液或无核酸酶水中,−20°C保存。
四、不同提取方法的对比分析
| 提取方式 | 优点 | 缺点 | 适用场景 |
| CTAB法 | 成本低、DNA完整 | 操作复杂、污染风险高 | 植物、土壤、真菌样本 |
| 酚/氯仿法 | 纯度高、经典可靠 | 有毒、费时 | 研究型实验室小样本 |
| 硅胶膜法 | 快速、安全、高通量 | 对高黏样本不友好 | 常规细菌、血液、细胞 |
| 磁珠法 | 自动化、产量高 | 成本略高 | 宏基因组、临床样本 |
| 商用试剂盒法 | 操作简便、稳定性高 | 成本高 | 任何类型的科研/检测项目 |
五、常见DNA提取问题与解决方案
| 问题 | 可能原因 | 解决方法 |
| DNA产量低 | 裂解不彻底、样本量不足 | 增加裂解时间或物理破碎强度 |
| OD260/280 < 1.8 | 蛋白残留 | 增加洗涤步骤或重抽提 |
| OD260/230 < 2.0 | 盐类/有机物污染 | 乙醇洗涤次数不够 |
| DNA粘稠/不溶 | 多糖污染 | 加入CTAB或NaCl中和 |
| PCR扩增失败 | 抑制剂残留 | 稀释DNA或再次纯化 |
📌小技巧:检测DNA质量时,建议同时采用Nanodrop测纯度 + 琼脂糖电泳看完整性,双保险!
六、试剂盒选择指南:如何挑到最适合你的那一款?
目前市面上常见的微生物DNA提取试剂盒品牌包括:
- Qiagen DNeasy系列
- Omega Bio-tek E.Z.N.A.®系列
- TIANGEN TIANamp系列
- MagPure磁珠法系列
- MoBio PowerSoil / DNeasy PowerLyzer(适合土壤样本)
选择时可以参考以下几个维度:
| 维度 | 建议 |
| 样本类型 | 选择对应类型的专用试剂盒(如Soil/Fecal/Bacterial) |
| DNA纯度要求 | 宏基因组测序或qPCR建议≥1.8 |
| 样本量 | 大体积样本选择磁珠法或柱式高载量试剂盒 |
| 预算与效率 | 日常科研推荐国产品牌;测序项目推荐Qiagen或Omega |
七、从提取到测序:DNA质量控制要点
在完成DNA提取后,以下三个指标最关键:
| 检测项目 | 合格标准 | 检测方法 |
| 浓度 | ≥20 ng/μL | Qubit或Nanodrop |
| 纯度 | OD260/280 = 1.8–2.0;OD260/230 > 2.0 | Nanodrop |
| 完整性 | 主要条带清晰,无降解拖尾 | 琼脂糖凝胶电泳 |
如需后续进行:
- PCR扩增:纯度要求高,建议稀释1:10使用。
- 高通量测序:建议额外纯化,去除多糖及蛋白残留。
八、实操建议与实验Tips
✅ 使用无核酸酶水和灭菌离心管,防止DNA降解。
✅ 样本混匀要充分,尤其是土壤和粪便类。
✅ 裂解后如出现絮状物,不要慌——静置离心再继续操作。
✅ 若样本极少,可采用carrier RNA提高回收率。
✅ 定期检查移液枪、吸头是否有交叉污染风险。
九、总结:DNA提取是一场“系统工程”
从样本到数据,DNA提取是分子实验的起点,也是成败的关键。
高质量DNA = 成功测序 + 准确分析的前提。
一句话总结👇
“看似简单的DNA提取,其实是科研稳定性的底层逻辑。”
只有做好这一步,后续的PCR、文库构建、测序分析才能顺利推进。
