在活体肠道“改写”细菌基因:小鼠体内碱基编辑实现共生菌精准改造
一、引子:从人类基因组到微生物基因组
过去二十年,CRISPR 技术的突破让人类基因组编辑从实验室走向了临床。但基因组不仅存在于人类自身,还广泛存在于寄居在我们体内的数以万亿计的微生物中。肠道菌群被誉为“第二基因组”,其基因数量是人类的 100 倍以上,对代谢、免疫、神经等多个系统具有深远影响。然而,如何在体内实现对肠道细菌的精准改造,一直是生物学和医学领域面临的巨大挑战。
2024 年,《Nature》发表的一项研究首次展示了在活体小鼠肠道中实现碱基编辑的可行性,研究者成功对共生菌基因进行精准改造,为微生物组工程开辟了新路径。这一成果标志着我们不仅能“写”自己的基因,还能在体内实时“改写”与我们共生的微生物基因。
二、研究背景:为什么要改造肠道细菌?
肠道菌群与人体健康的关系日益明确。越来越多的证据显示,菌群失衡与肥胖、糖尿病、炎症性肠病、神经退行性疾病甚至精神疾病都有密切关联。如果能在体内直接对特定细菌基因进行改造,就能从源头上调控微生物的功能,从而影响宿主健康。与传统的益生菌补充或粪菌移植相比,体内基因编辑能提供更精准、更持久的干预方式。
三、研究设计:体内碱基编辑的策略
研究团队基于以下思路:
1. **选择适合的编辑工具**:采用改良的 CRISPR-Cas 碱基编辑器,能够实现 A→G 或 C→T 的单碱基替换,避免了双链切割的高风险。
2. **递送系统**:使用工程化噬菌体和质粒系统,将编辑工具携带到小鼠肠道的目标细菌中,实现高效递送。
3. **目标选择**:挑选肠道共生菌中的特定代谢基因作为编辑对象,以验证技术的可行性。
4. **监测手段**:通过宏基因组测序和单菌株分离鉴定,评估编辑效率与稳定性。
四、主要结果:在小鼠体内成功实现菌群改造
实验结果显示:
1. **高效编辑**:在特定共生菌(如拟杆菌属)中,单次递送即可实现 50% 以上的基因编辑效率。
2. **稳定遗传**:编辑产生的突变在细菌种群中稳定传递,至少可维持数周。
3. **功能验证**:当研究团队编辑了与糖代谢相关的基因后,小鼠血糖水平和肠道代谢产物谱发生明显改变,证明这种编辑对宿主生理有实质性影响。
4. **生态安全性**:未观察到显著的肠道微生物多样性丧失或有害菌过度生长。
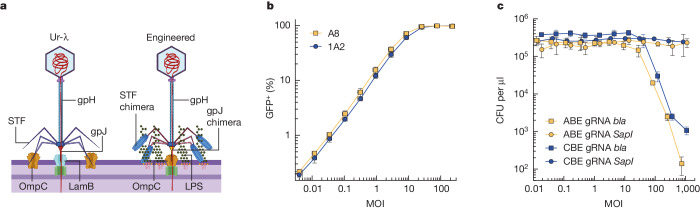
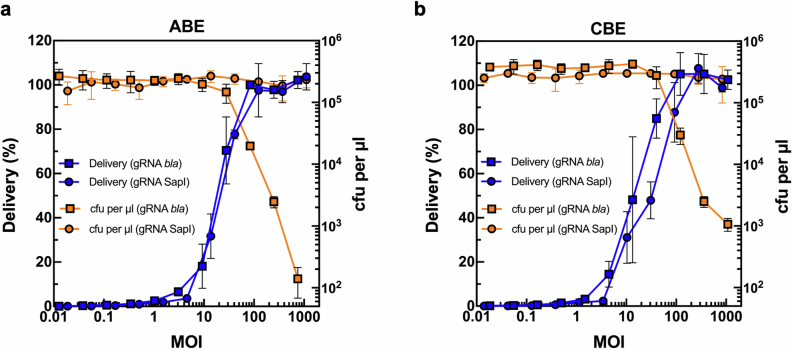
五、科学意义:微生物组工程的新纪元
这一成果的意义在于,它证明了体内菌群可以被直接、精准地改写。未来可能的应用包括:
1. **代谢疾病干预**:通过编辑菌群代谢基因,调控宿主能量摄取与利用;
2. **免疫调控**:利用改造细菌影响免疫因子分泌,从而治疗炎症性疾病或自身免疫病;
3. **神经精神疾病研究**:通过菌群-肠-脑轴,探索抑郁、焦虑、阿尔茨海默症等疾病的干预;
4. **精准营养学**:根据个体基因组与菌群特征,定制化设计饮食干预方案。
六、与现有方法的比较
– **益生菌补充**:多数外源菌难以长期定殖,效果有限;
– **粪菌移植**:虽能部分重建菌群,但不可控性强,存在病原风险;
– **体外改造再移植**:操作复杂,移植后稳定性差;
– **体内基因编辑**:直接在宿主环境中改写菌群,效率高且持久,未来更具潜力。
七、局限与挑战
尽管取得突破,但该研究仍有局限:
1. **编辑效率的提升**:虽然 50% 已经很高,但在多样化菌群环境下,效率仍需进一步优化。
2. **脱靶风险**:如何避免非目标菌株或基因被意外编辑,是未来研究的重点。
3. **递送策略**:在小鼠中验证成功,但在人类复杂肠道中如何实现高效递送仍是难点。
4. **伦理与监管**:在人类体内直接改造微生物基因涉及伦理、安全和长期生态风险,需要严格监管。
八、未来展望
1. **跨物种应用**:不仅是小鼠,人类肠道乃至皮肤、口腔等微生物群都可能成为编辑对象。
2. **联合疗法**:与药物、饮食、免疫治疗结合,形成多模态干预。
3. **精准医学**:为不同个体设计个性化的菌群编辑方案,达到真正意义上的“定制医疗”。
4. **长期随访**:需要在大动物和临床试验中进行长期观察,确保安全性和疗效。
九、结语
这项研究标志着人类首次在活体动物体内实现对肠道共生菌的精准基因编辑,为未来微生物组工程和精准医学提供了强大工具。虽然仍处于早期阶段,但它为治疗代谢疾病、免疫紊乱甚至神经精神疾病提供了全新思路。未来十年,随着递送系统和编辑工具的不断优化,我们或许能真正“编程”肠道菌群,让其成为健康的守护者。
