凋亡与坏死怎么区分?三种染色方案对比
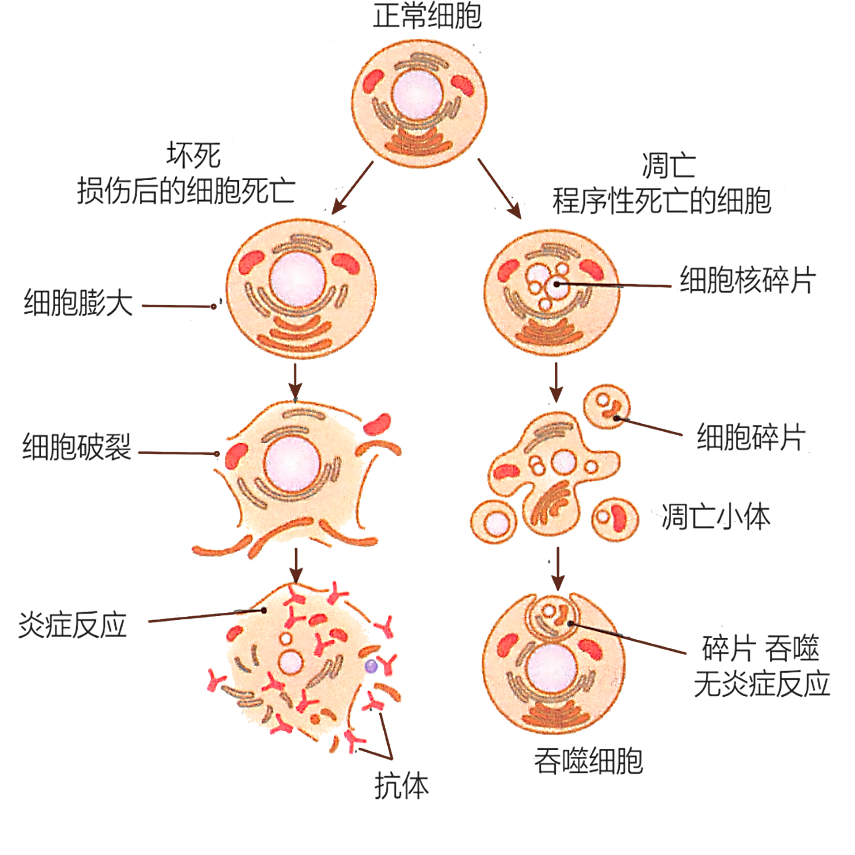
在细胞生物学和药效评价实验中,判断细胞是“主动死亡”还是“被动牺牲”非常关键。凋亡(Apoptosis)和坏死(Necrosis)是两种截然不同的死亡方式,涉及不同的分子机制和生理意义。尤其在药物毒性评估、抗肿瘤机制研究等领域,准确地区分凋亡与坏死是设计实验和解读结果的基础。
本篇将详细对比三种常用的细胞死亡染色方法,帮助你明确适用场景、原理差异和数据分析要点。
图片来源于“普拉特泽”公司官网
一、凋亡与坏死:你真的分得清吗?
| 特征 | 凋亡 | 坏死 |
| 发动方式 | 主动(程序性) | 被动(意外损伤) |
| 细胞膜 | 完整→最终破裂 | 早期即破裂 |
| PS外翻 | 有 | 无显著特征 |
| 炎症反应 | 无 | 明显诱发 |
| 核染色 | 凝聚、碎裂 | 弥散、膨胀 |
| 可逆性 | 不可逆,但可被抑制 | 不可逆 |
因此,从膜完整性、PS外翻、DNA降解、酶活性变化等多个角度入手,才能更准确地区分凋亡与坏死。
二、三大经典染色方案对比
方案一:Annexin V-FITC / PI 双染法(流式细胞术)
✅ 原理:
Annexin V 结合凋亡细胞膜外翻的PS
PI 仅进入膜破裂的晚期凋亡或坏死细胞
✅ 实验优点:
快速、灵敏
区分正常、早期凋亡、晚期凋亡、坏死四类细胞
可用于活细胞状态分析,适用于流式细胞仪或荧光显微镜
✅ 分析方式:
| 象限 | 信号 | 细胞状态 |
| Q4(Annexin– / PI–) | 双阴 | 正常细胞 |
| Q3(Annexin+ / PI–) | Annexin⁺ | 早期凋亡 |
| Q2(Annexin+ / PI+) | 双阳 | 晚期凋亡 |
| Q1(Annexin– / PI+) | PI⁺ | 坏死 |
注意事项:
染色需避光、适当时间控制在15–20分钟内
Buffer需含Ca²⁺以支持Annexin结合
适用场景:
快速判断凋亡比例
药物毒性评估
剂量与时间依赖实验
方案二:Hoechst 33342 / PI 双染法(荧光显微镜)
✅ 原理:
Hoechst 33342穿透活细胞膜结合DNA,标记所有细胞核PI标记死亡或膜破裂细胞
✅ 实验优点:
可观察核染色形态学变化:凋亡细胞呈亮蓝色、核凝聚、碎裂适用于活细胞实时观察
✅ 数据解读:
| 染色模式 | 判断依据 |
| Hoechst染色增强、核缩小 | 凋亡 |
| Hoechst弱+PI阳性 | 坏死 |
| 双阳(Hoechst增强+PI) | 晚期凋亡或继发坏死 |
注意事项:
染色浓度需严格控制,过量Hoechst可致毒性
显微观察较主观,需配合图像定量软件分析
适用场景:
细胞形态验证
与流式数据互补印证
低通量药效筛查
方案三:TUNEL 检测(荧光或免疫染色)
✅ 原理:
TUNEL(Terminal deoxynucleotidyl transferase dUTP Nick-End Labeling)法能标记凋亡过程中DNA链断裂的3′-OH末端,特异性识别**晚期凋亡细胞。
✅ 实验优点:
特异性强,直观反映DNA降解
可结合组织切片、石蜡标本进行原位染色
✅ 数据呈现:
TUNEL阳性细胞荧光增强,通常配合DAPI做核背景染色
结合组织形态分析凋亡分布
注意事项:
主要识别晚期凋亡,早期可能漏检
染色时间较长,需较强实验操作基础
需设置DNase处理阳性对照和无TdT阴性对照
适用场景:
组织病理样本分析
肿瘤组织凋亡定位
长期药物处理后的凋亡检测
三、三种方法对比总结
| 方法 | 检测类型 | 检测阶段 | 优点 | 局限性 |
| Annexin V/PI | 流式 | 早期+晚期凋亡、坏死 | 快速、定量 | 不适用于组织切片 |
| Hoechst/PI | 显微 | 形态+凋亡/坏死 | 实时观察、形态直观 | 主观性强、通量低 |
| TUNEL | 免疫染色 | 晚期凋亡 | 特异性高、适用于组织 | 检测周期长、漏检早期凋亡 |
四、组合使用才是王道
在实际研究中,仅凭单一染色方法往往难以全面掌握细胞死亡状态。推荐的组合策略包括:
流式 + 显微:Annexin V/PI流式快速筛查,Hoechst/PI验证凋亡形态
TUNEL + IHC双染:组织样本中同时标记凋亡细胞和特定细胞亚群
Annexin + 活性染料:结合Caspase 3/7活性探针,增强凋亡识别准确性
多角度染色验证,是建立科学结论的基础。
五、结语
在细胞凋亡与坏死的研究中,理解各类染色方案的本质差异,并根据实验目标和样本类型选择合适方法,才能获得可靠、精准的数据。别再让染色“走流程”,用好它们,你的实验就能看得更“透”!
