肿瘤皮下瘤模型的建模实录与注意事项
在肿瘤研究领域,小鼠皮下瘤模型(Subcutaneous Tumor Model)是应用最广泛的一类肿瘤动物模型,具有操作简单、成本低、肿瘤易监测等优点。无论是做新药筛选、肿瘤免疫研究,还是靶点验证,皮下瘤模型几乎都是绕不开的“必修课”。
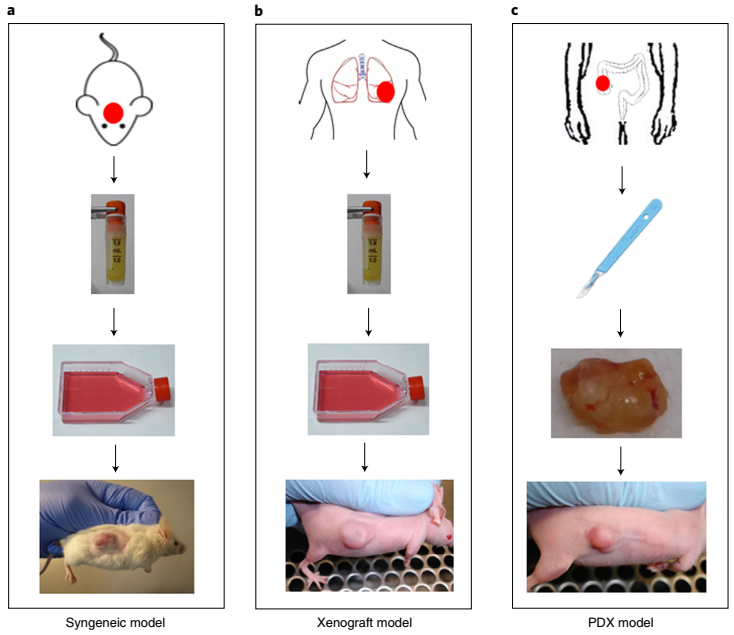
图片来源于知乎“EngineeringForLife”
但建模容易,建好不易,你是否也遇到过这些情况:
肿瘤长不出来,接种失败;
长出来了,但大小差异大,实验结果不理想;
文章投稿,被质疑动物模型不规范?
别慌,今天就带大家一起系统梳理皮下瘤模型的标准建模流程与实用经验技巧,帮助你一次建模成功,提高SCI论文质量。
一、皮下瘤模型适用于哪些研究?
抗肿瘤药物筛选与疗效评价
肿瘤生长动力学观察
肿瘤组织学和分子生物学研究
肿瘤微环境与免疫研究
肿瘤代谢与血管生成研究
优点:
✅ 建模周期短
✅ 肿瘤体积可直观测量
✅ 易于取材与组织分析
缺点:
❗ 与原位肿瘤差异较大,不完全模拟肿瘤微环境
二、建模前的准备工作
- 动物选择
种属:常用裸鼠(BALB/c-nu)、C57BL/6、BALB/c等
性别与年龄:推荐雄性,6~~8周龄,体重18~~22 g
来源:正规SPF级动物实验中心
- 肿瘤细胞准备
细胞系选择:根据实验需求选择(如HepG2、MCF-7、4T1等)
状态要求:对数生长期、无污染
接种密度:一般为1×10⁶ \~ 5×10⁶个细胞/只
- 细胞悬液配置
溶剂:PBS或不含血清的培养基
体积:100\~200 μL/只
可选添加:Matrigel(促进成瘤率,推荐1:1混合)
三、标准建模步骤
- 细胞收集
- 贴壁细胞胰酶消化(或悬浮细胞直接离心)
- PBS洗涤2次,离心去上清
- 重悬至设定浓度(1×10⁷ cells/mL)
- 接种方法
接种部位:小鼠右侧腋下或背部皮下
消毒:酒精棉球消毒接种区域
注射方式:
单手轻提小鼠背部皮肤,形成“囊袋”
用微量注射器(1 mL胰岛素针)缓慢推进
进针后确认未回抽出血液,缓慢推注
注射后轻压针孔处,防止细胞溢出
- 成瘤监测
时间:多数肿瘤细胞5\~7天形成肉眼可见肿块
体积测量:
V = 1/2 x 长 x 宽2
推荐每2\~3天测量1次,绘制生长曲线
四、常见问题与对策
| 问题 | 可能原因 | 解决方案 |
| 成瘤率低 | 细胞状态差 / 浓度过低 | 确保细胞活性,对数生长期接种,适当添加 Matrigel |
| 成瘤不均匀 | 接种操作不一致 / 动物个体差异大 | 同一操作者操作,随机分组,适当增加动物数量 |
| 肿瘤坏死 | 肿瘤过大,中央供血不足 | 设定人道终点,肿瘤直径不超过1.5 cm |
| 接种部位感染 | 无菌操作不严格 | 严格消毒,操作尽量快速干净 |
| 肿瘤体积测量误差大 | 手法不稳定 | 固定测量人员,标记测量部位 |
五、动物伦理与人道终点
伦理批准编号:需在论文方法部分注明
人道终点设置:
肿瘤直径≥1.5 cm 或 体重下降≥20%
活动能力显著下降、出现溃烂等
安乐死方法:超量麻醉或CO₂吸入法
六、提高建模质量的实用技巧
预实验:正式实验前建议先做1\~2组小规模预实验,验证细胞接种剂量和成瘤效率。
冻存细胞恢复培养时间≥2代:避免冷冻细胞直接接种,影响成瘤率。
使用Matrigel混合悬液接种:特别适用于不易成瘤的细胞系,如MCF-7。
肿瘤体积差异均衡分组:肿瘤形成后再进行正式分组,避免因肿瘤大小差异影响数据统计。
记录详细:接种日期、成瘤时间、肿瘤体积变化,便于数据追溯。
总结
肿瘤皮下瘤模型虽然属于基础入门型肿瘤模型,但建模细节决定实验成败。一个标准的肿瘤动物实验,离不开:
规范的动物选择与饲养条件;
合理的细胞悬液制备;
严谨的操作流程与无菌意识;
清晰明确的实验分组与终点设定。
做好这些,你的肿瘤动物实验不仅能高效产出数据,也能为后续SCI论文发表打下坚实基础。
