TIGR‑Tas:比 CRISPR 更小、更自由的 RNA‑引导 DNA 编辑新星
【导语】
自 2012 年 CRISPR‑Cas9 横空出世,“基因剪刀”成为合成生物学最闪耀的符号。但在实际临床和农业场景里,人们很快发现 Cas9 长约 1368 个氨基酸、编码序列动辄 4.2 kb,想把这么大的“剪刀”塞进腺相关病毒(AAV)等常用载体并不轻松。2025 年,Nature 子刊与 MIT 新闻几乎同步报道了一套全新的 RNA‑引导 DNA 靶向系统——TIGR‑Tas(Tandem‑repeat‑containing guides and Tas proteins),它不需要 PAM 序列触发,核心 Tas 蛋白只有 Cas9 四分之一大小,却依旧能在人类细胞中完成精准双链切割。学界普遍认为,TIGR‑Tas 有望接过 CRISPR 之后的下一支接力棒。本文带你读懂这把微型“剪刀”的结构机理、发现历程与应用前景。
一、TIGR‑Tas 究竟“瘦”在哪里?
TIGR‑Tas 系统由两部分组成:一是被称为“tigRNA”的 TIGR array 小 RNA;二是与之相伴的 Tas 蛋白。现已解析的三种亚型——TasA、TasH 与 TasR,最小的 TasA 仅 310 个氨基酸,就连最大的 TasR 也不过 450 aa,比 1368 aa 的 SpCas9 要迷你得多。体积小意味着基因治疗时更易打包、更省成本,也降低了免疫原性。
二、双 spacer 机制:左右开弓锁定靶点
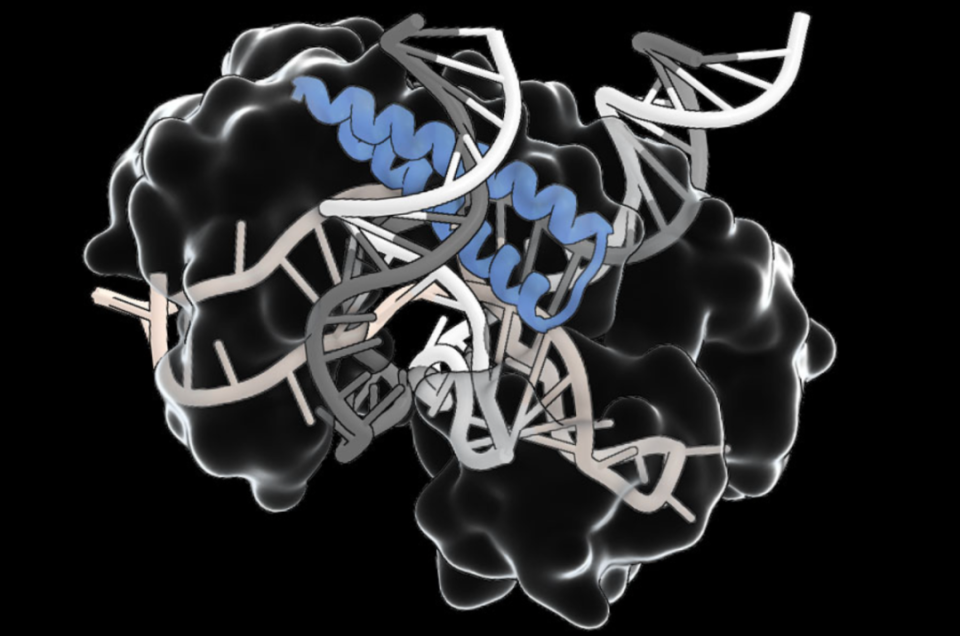
不同于 CRISPR 单条 gRNA 识别单链,tigRNA 内含两段 9 nt 的 Spacer A/B,A 与靶 DNA 正义链配对,B 与反义链互补,形成“钳式”夹击。只有两段都精确匹配时 Tas 才会切割,这天然提高了特异性。更令人惊喜的是,Tas 不要求靶序列两侧存在 PAM,因此理论上全基因组 99.8% 区域都可编程编辑。
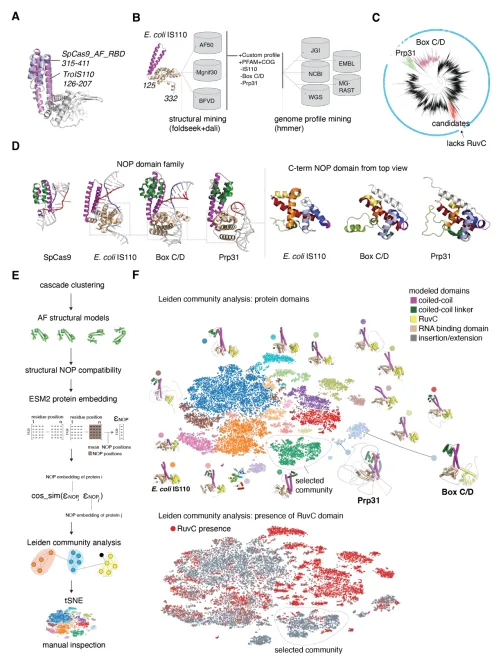
三、分子结构:Nop 域牵头,RuvC/HNH 扫尾
结构生物学显示,Tas 核心由一个 box C/D snoRNA 类似的 Nop 折叠框架支撑,引导 tigRNA 构形;C 端则分别融合 HNH、RuvC 或无核酸酶版本。研究者发现,TasR 的 RuvC 活性中心可产生 8‑nt 3′ 悬臂切口,与 Cas12a 的 5′ 悬臂形成互补。若将 Tas 与其他端粒整合酶、碱基编辑器拼接,或可解锁更丰富的编辑花样。
四、发现之旅:AI + 进化挖掘双管齐下
这把“剪刀”并非在实验室偶然撞见,而是计算生物学家借助大规模元基因组数据,利用深度学习扫描 RNA‑蛋白共现模式时挑选出来的“暗物质”家族。随后,团队在古菌与病毒样品中合成表达 Tas+TIGR array,验证了其 DNA 切割活性。最后,将 TasR mRNA 与定制 tigRNA 共转人类 HEK293 细胞,观察到 GFP 报告基因 40% 的敲除效率,确认其跨界潜力。
五、与 CRISPR‑Cas9 的“五大差异”
- **无需 PAM**:摆脱 NGG/NGRR 限制,设计窗口几乎覆盖全基因组。
- **双导 RNA**:两段 9 nt 配对提高特异性,降低脱靶。
- **尺寸微型**:编码序列可轻松放入 AAV,甚至单质粒携带多重编辑位点。
- **剪切模式**:生成 8‑nt 3′ 悬臂,为定向插入提供便利。
- **演化来源**:与 snoRNP 亲缘更近,提示 RNA‑指导系统多起源并存。
六、潜在应用:小身材也能干大事
◇ **体内基因治疗**:单 AAV 载体塞下 Tas + 双 tigRNA cassette,为肌萎缩、遗传性耳聋等大基因难递送疾病开绿灯。
◇ **作物精准育种**:无 PAM 限制让保守启动子、激活子可任意编辑,提高抗逆或营养性。
◇ **活细胞成像**:将 Tas 融合荧光蛋白,利用双 spacer 高特异性做实时 DNA 追踪。
◇ **分子诊断**:改造 Tas 无核酸酶版作“分子钳”,与荧光报告配对检测微量病原。
七、风险与挑战
➤ **脱靶黑盒**:虽然双 spacer 提升选择性,但变异容忍度尚未系统刻画;高通量测序脱靶图谱仍缺乏。
➤ **免疫激活**:Tas 来自古菌或噬菌体,是否触发 TLR 或 cGAS‑STING 通路需体内验证。
➤ **RNA 加工依赖**:TIGR array 的精细切割机制尚未解析,外源宿主可能加工效率不足。
➤ **生态安全**:比 Cas9 更易水平转移,需建立生物安全阀。
八、结语:微型“剪刀”启幕后 CRISPR 时代?
CRISPR‑Cas9 曾把基因编辑阈值拉到前所未有的低点;TIGR‑Tas 证明,天地之大,RNA‑引导 DNA 系统远不止一种。更小、更自由、更易递送,意味着科研和临床手里的工具箱又多了一把锋利而轻巧的刀。未来十年,人们或许会见到 Tas 与碱基编辑、表观编辑、可逆编辑等模块自由拼装,乃至被写进可穿戴纳米机器人中执行体内修复。对基因组学来说,这既是挑战,也是宇宙级机会。愿这把“微型剪刀”真正走进实验室与病房,带来更安全、更普惠的基因疗法。
