癌症转移的 “神秘信使”:外泌体如何为肿瘤 “铺路”?
在癌症治疗的战场上,肿瘤转移始终是最棘手的难题 —— 明明原发灶已被手术切除或药物控制,癌细胞却能像潜伏的间谍一样,悄无声息地转移到肺、肝、脑等远隔器官,形成致命的新病灶。据统计,约 90% 的癌症患者死亡与肿瘤转移相关。近年来,科学家通过深入研究发现,这场 “远程突袭” 的幕后推手,竟是细胞分泌的一种纳米级 “快递包裹”—— 外泌体。
什么是外泌体?
外泌体是细胞主动释放的直径约 30-150 纳米的囊泡结构,相当于头发丝直径的千分之一。这些微小囊泡像一个个精心打包的微型 “信息包”,里面装满了蛋白质、核酸(DNA、RNA)、脂质等生物分子。早在上世纪 80 年代,外泌体就被科学家从羊的网织红细胞中发现,但当时它被误认为是细胞排出代谢废物的 “垃圾囊”,并未引起足够重视。
随着技术的进步,研究人员通过电子显微镜观察到外泌体具有典型的杯状结构,并且表面携带大量特异性标志物,如 CD9、CD63、TSG101 等。更重要的是,2015 年《Nature》杂志发表的一项里程碑研究证实,外泌体并非无用的 “垃圾”,而是细胞间通讯的关键媒介。特别是肿瘤细胞分泌的外泌体,堪称精准的 “侦察兵”,能提前为癌细胞转移 “踩点铺路”,这项发现彻底改变了人类对肿瘤转移机制的认知。
外泌体:肿瘤转移的 “导航系统”
肿瘤转移素有 “种子 – 土壤” 假说,即肿瘤细胞(种子)需要找到适合生长的微环境(土壤)才能定植生长。而外泌体正是连接 “种子” 与 “土壤” 的关键桥梁。2015 年的这项研究通过严谨的实验证实,不同肿瘤的外泌体带着独特的 “导航设备”—— 整合素蛋白,能够精准定位转移目标器官。
研究团队采用差速离心法从肺癌、肝癌等不同肿瘤细胞的培养上清中分离出外泌体,通过荧光标记技术追踪外泌体在小鼠体内的分布。结果令人震惊:肺癌细胞分泌的外泌体表面富集 α6β4 和 α6β1 整合素,这些 “导航蛋白” 就像安装了 “肺部导航” 系统,能带领外泌体优先聚集到肺部组织;而肝癌细胞的外泌体则携带高表达的 αvβ5 整合素,会直奔肝脏 “安营扎寨”;后续研究还发现,携带 αvβ3 整合素的外泌体与脑转移密切相关。
为验证这些整合素的作用,研究人员通过基因编辑技术敲低肿瘤细胞中特定整合素的表达,再观察外泌体的靶向能力。实验显示,敲低 α6β4 后,肺癌外泌体在肺部的聚集量减少了 70% 以上,同时肺转移灶的形成也显著减少。这一发现首次证实,外泌体表面的整合素表达模式决定了肿瘤转移的器官趋向性,就像快递包裹上的地址标签,确保外泌体能精准送达目标器官。
外泌体如何 “改造” 转移土壤?
外泌体抵达靶器官后,并非简单地传递信息,而是通过一系列精密操作 “改造” 当地环境,为后续癌细胞转移打造适宜的 “沃土”。研究发现,外泌体主要通过三重手段构建 “转移前微环境”:
第一重手段是激活 “工程队”。外泌体携带的表皮生长因子受体(EGFR)等信号分子,能与靶器官中的成纤维细胞表面受体结合,激活 PI3K/AKT 等信号通路。被激活的成纤维细胞会像勤劳的工程队,大量分泌胶原蛋白、纤连蛋白等成分,重塑细胞外基质结构,为癌细胞打造 “舒适居所”。实验显示,经外泌体处理的成纤维细胞,其基质金属蛋白酶(MMPs)的表达量可提升 3-5 倍,这些酶能有效降解原有组织结构,为癌细胞入侵开辟道路。
第二重手段是招募 “保护伞”。外泌体进入靶器官后,会被巨噬细胞等免疫细胞吞噬。但令人意外的是,这些外泌体不仅没有被清除,反而诱导巨噬细胞向 M2 型极化(肿瘤相关巨噬细胞)。这些被 “策反” 的巨噬细胞会分泌 IL-6、TNF-α 等促炎因子,形成局部免疫抑制环境,就像为癌细胞撑起 “保护伞”,让后续到达的癌细胞能够避开免疫系统的攻击。
第三重手段是铺设 “补给线”。外泌体释放的血管内皮生长因子(VEGF)等信号分子,能促进靶器官内新生血管生成。这些新生成的血管就像为癌细胞铺设的 “补给线”,源源不断地输送氧气和营养物质,确保癌细胞定植后能够快速生长。研究人员通过活体成像观察发现,外泌体注射后 7-10 天,靶器官区域的血管密度可增加 2-3 倍。
经过这番全面改造,原本不适宜癌细胞生存的正常器官组织,就变成了利于肿瘤生长的 “沃土”。当循环系统中的癌细胞随血液到达这里时,便能顺利定植并迅速形成转移灶。
靶向外泌体:阻断转移新策略
这项关于外泌体与肿瘤转移机制的研究,为癌症治疗带来了全新的希望。既然外泌体是肿瘤转移的 “关键信使”,那么阻断它的功能就能从源头阻止转移发生,这为开发新型抗癌策略提供了重要思路。
在诊断方面,外泌体有望成为精准预测转移的 “生物标志物”。研究发现,不同转移趋向的肿瘤外泌体具有独特的整合素表达谱,通过检测血液中这些特异性外泌体的含量,就能提前预测肿瘤可能转移的器官。例如,乳腺癌患者血清中 α6β4 整合素高表达,提示肺转移风险增加;而 αvβ5 高表达则可能预示肝转移。这种液体活检技术具有无创、便捷的优势,能够实现转移风险的早期评估和干预。
在治疗方面,靶向外泌体的策略主要有三种:一是 “精准拦截”,研发针对特定整合素的单克隆抗体,像 “拦截导弹” 一样阻止外泌体与靶器官细胞结合。动物实验显示,抗 α6β4 抗体能使肺癌转移灶减少 50% 以上;二是 “釜底抽薪”,通过抑制外泌体分泌相关分子(如 Rab27a 蛋白),减少肿瘤细胞释放外泌体的数量;三是 “改造利用”,将外泌体改造成 “药物载体”,利用其天然的靶向性,将化疗药物或基因治疗药物精准递送到转移灶,提高治疗效果并减少副作用。
目前,基于外泌体的液体活检技术已进入临床验证阶段,多项外泌体靶向药物的临床试验也在全球范围内开展。2023 年,美国 FDA 已授予一种外泌体检测试剂盒 “突破性医疗器械” 认定,用于胰腺癌的早期诊断。随着技术的不断成熟,这些曾经助纣为虐的 “纳米信使”,有望从癌症的帮凶转变为抗癌的利器。
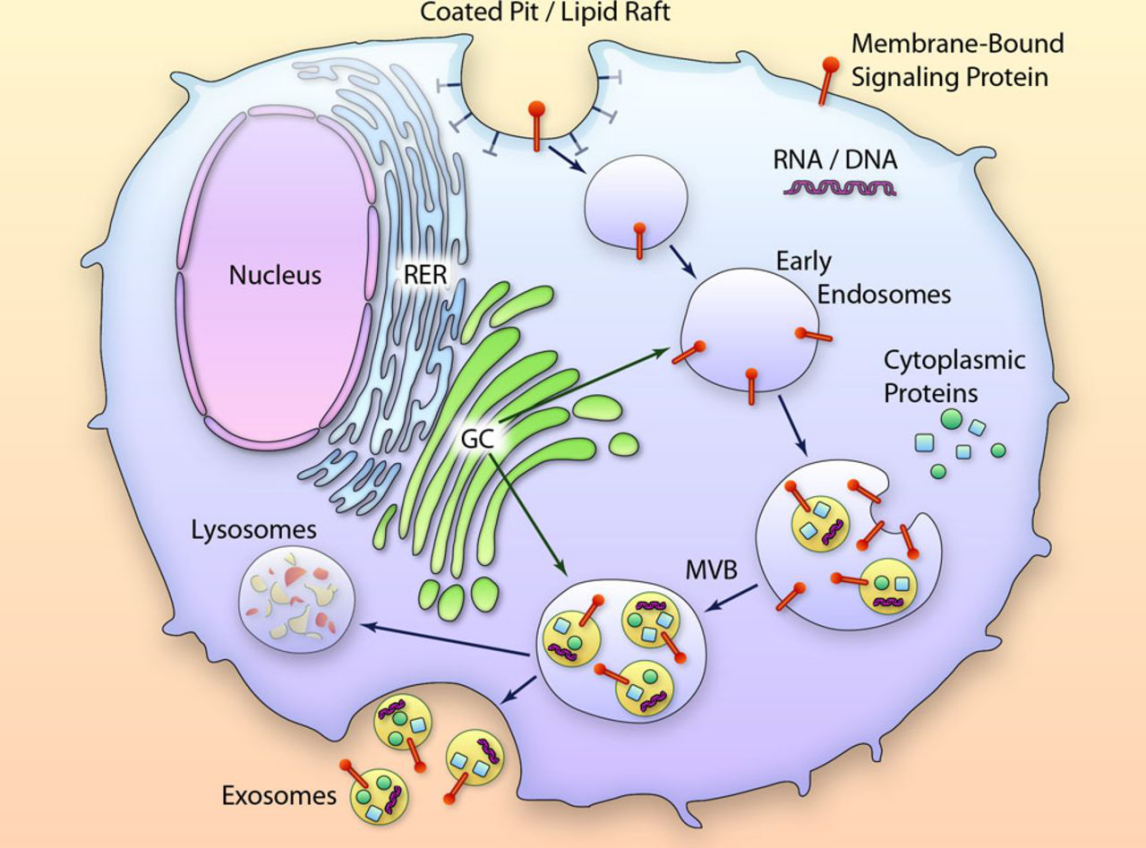
外泌体的发现揭开了肿瘤转移的神秘面纱,也让人类在攻克癌症的道路上迈出了关键一步。这些曾经被忽视的 “小囊泡”,正在改变我们对癌症发生发展机制的认知。随着研究的不断深入,相信在不久的将来,基于外泌体的诊断技术和治疗方法将广泛应用于临床,为癌症患者带来新的希望。关注癌症研究前沿,让我们一起期待更多抗癌新突破!
