细胞侵袭实验:如何判断细胞是否“穿”过去了?
在肿瘤研究和药物开发中,细胞侵袭实验是评估细胞迁移和侵袭能力的关键技术。无论是研究癌细胞的转移机制,还是筛选抗肿瘤药物,科研人员都需要准确判断:细胞是否真的“穿”过了基质屏障?
一、什么是细胞侵袭实验?
细胞侵袭实验通常采用Transwell小室(也称Boyden小室)进行。这套系统分为上下两个室,中间由一层多孔聚碳酸酯膜隔开。膜上涂有基质胶(Matrigel),模拟体内的细胞外基质屏障。
上室接种待测细胞,下室加入化学引诱剂(如胎牛血清或特定趋化因子)。如果细胞具有侵袭能力,它们会分泌酶降解基质胶,穿过膜上的微孔,到达膜的下表面。
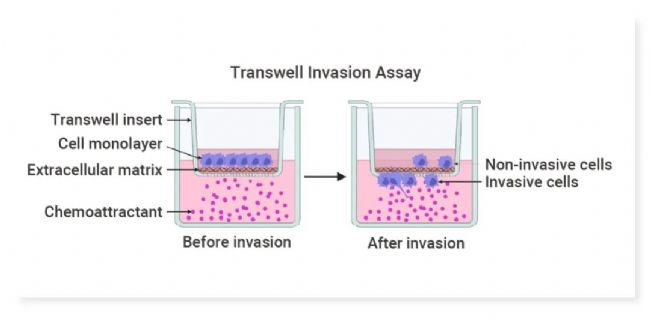
细胞侵袭实验示意图(图片来自百度)
二、如何判断细胞是否侵袭过去?
- 直接计数法(金标准)
实验结束后,取出Transwell膜,固定并染色(常用结晶紫、吉姆萨或DAPI等染料),然后在显微镜下直接计数穿过的细胞。
具体步骤:
– 取出Transwell膜,用PBS轻轻清洗
– 用棉签轻轻擦去膜上表面未侵袭的细胞
– 用4%多聚甲醛固定膜下表面的细胞
– 使用0.1%结晶紫溶液染色10-20分钟
– 用清水轻轻冲洗并晾干
– 在光学显微镜下随机选择多个视野计数细胞
- MTT比色法
对于高通量筛选,可采用MTT比色法进行间接定量。原理是MTT被活细胞线粒体内的琥珀酸脱氢酶还原为不溶性的紫色甲臜结晶,结晶溶解后可通过酶标仪测定吸光度值。
优点:适合大规模实验,客观性强
缺点:无法观察细胞形态,可能受到细胞增殖影响
- 荧光标记法
用荧光染料(如Calcein-AM)预标记细胞,细胞穿过膜后,使用荧光酶标仪直接检测下室中的荧光强度,定量分析细胞侵袭数量。
进阶应用:表达荧光蛋白(如GFP)的稳定细胞系可使检测更加简便,无需染色步骤。
三、提高实验准确性的关键技巧
- 设置对照实验
– 阳性对照:使用已知高侵袭能力的细胞系(如MDA-MB-231乳腺癌细胞)
– 阴性对照:使用低侵袭能力的细胞系(如MCF-7乳腺癌细胞)
– 空白对照:下室不添加趋化因子,评估随机迁移
- 优化实验条件
– 基质胶浓度要适中(通常1-2 mg/mL)
– 细胞接种量要优化(通常5×10^4-1×10^5细胞/孔)
– 培养时间要恰当(通常24-48小时)
- 避免常见错误
– 擦除上表面细胞时要轻柔且彻底,避免假阳性
– 膜孔堵塞会影响结果,需确保细胞悬液无团块
– 注意气泡问题,气泡会阻碍细胞迁移
四、数据分析与结果解读
细胞侵袭实验的结果通常表示为:
– 穿膜细胞数(每视野)
– 侵袭细胞百分比(相对于总细胞数)
– 侵袭指数(实验组/对照组)
统计时需至少重复3次独立实验,每次设3个复孔,采用t检验或ANOVA进行统计分析。
五、进阶技术:实时监测细胞侵袭
传统Transwell实验只能提供终点数据,而新型技术如xCELLigence实时细胞分析系统可以动态监测细胞侵袭过程,提供更丰富的动力学数据。
六、结语
准确判断细胞是否侵袭过去是细胞侵袭实验的核心。通过优化实验条件、设置合理对照、采用适当的检测方法和严谨的数据分析,研究人员可以获得可靠的结果,为肿瘤转移机制研究和抗肿瘤药物开发提供有力支持。
科学研究在于细节,每一个步骤的精心设计都可能影响最终结果的可靠性。掌握这些关键技术点,让你的细胞侵袭实验更加精准可信!
