一次给药、长期缓解:NTLA-2002 体内 CRISPR 治疗遗传性血管性水肿的临床突破
一、引子:遗传性血管性水肿的沉重负担
遗传性血管性水肿(Hereditary Angioedema,HAE)是一种罕见但严重的遗传病,其核心特征是反复发作的皮肤、胃肠道以及喉部水肿。尤其是喉头水肿,可能在数小时内危及生命。该病由补体和激肽系统调控异常引起,主要机制与血浆激肽释放酶(plasma kallikrein, KLKB1 基因编码)相关。KLKB1 过度活化导致缓激肽(bradykinin)生成增加,从而诱发血管通透性升高与水肿。
传统治疗包括 C1 抑制物替代、抗激肽药物(如 icatibant)以及 kallikrein 抑制剂(如 lanadelumab)。虽然这些药物能够控制症状,但通常需要长期或反复给药,患者依从性差,且经济负担沉重。因此,如何通过“一次治疗”来实现持久缓解,一直是罕见病领域的核心诉求。
二、研究背景:NTLA-2002 的研发逻辑
NTLA-2002 是 Intellia 公司开发的一种体内 CRISPR-Cas9 基因编辑疗法,靶向 KLKB1 基因。它通过脂质纳米颗粒(LNP)将 Cas9 mRNA 与导向 RNA(sgRNA)递送至肝脏细胞,在基因组层面敲除 KLKB1,从而持久降低 kallikrein 水平。其理论优势在于:一次静脉输注即可实现长期甚至终身疗效,减少甚至消除 HAE 发作。
三、研究设计:I/II 期临床试验框架
2024 年《新英格兰医学杂志》发表了 NTLA-2002 的早期临床结果。这是一项开放标签的 I/II 期研究,设计要点包括:
1. 入组对象:既往确诊为 HAE 且发作频繁(平均每月 ≥2 次)的成年患者。
2. 治疗方式:单次静脉输注 NTLA-2002,分为低、中、高剂量组。
3. 主要终点:安全性与耐受性。
4. 次要终点:血浆 kallikrein 水平下降、血管性水肿发作频率变化。

四、主要结果:强效且持久的疗效
研究共纳入 10 余名患者,随访超过 1 年。主要结果如下:
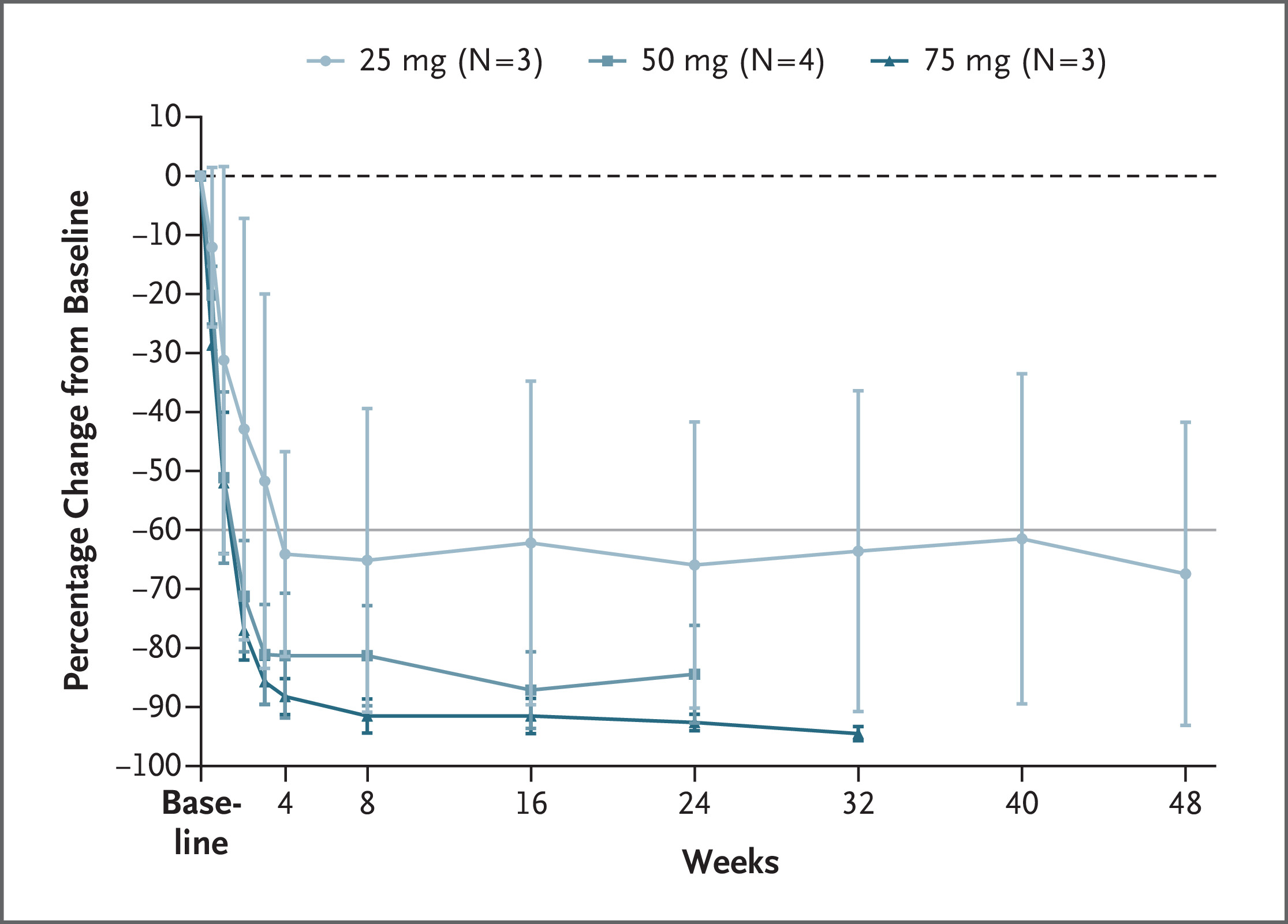
1. **Kallikrein 持久下降**:所有剂量组患者在给药后 28 天内血浆 kallikrein 水平均迅速下降,且在 12 个月时依然维持低水平。
2. **发作频率显著减少**:在中高剂量组,患者平均 HAE 发作减少超过 90%。部分患者在随访期间未再出现任何一次发作。
3. **药物需求大幅下降**:接受 NTLA-2002 治疗后,大多数患者不再需要常规预防或急救药物。
4. **安全性**:治疗耐受良好,最常见不良反应为一过性输注相关反应(如发热、寒战),未出现严重免疫反应或剂量限制性毒性。
五、临床与科学意义
1. **罕见病治疗的模式转变**:NTLA-2002 展示了“单次基因编辑,长期获益”的可能性,突破了以往依赖长期给药的模式。
2. **靶点选择的合理性**:KLKB1 是 HAE 发病的关键分子,编辑它能从病因层面控制疾病。
3. **LNP 递送的可行性**:该研究进一步验证了 LNP 在肝脏定向递送中的有效性,为其他基因疾病治疗提供范例。
4. **对患者生活质量的影响**:长期无发作意味着患者可以摆脱频繁的药物依赖与对窒息发作的恐惧,大幅改善生活质量。
六、挑战与局限
1. **长期安全性仍待验证**:随访虽已超过 1 年,但仍需更长期的数据来确认持久疗效与潜在风险。
2. **脱靶效应**:尽管目前未发现临床相关问题,但基因编辑的潜在脱靶风险需要持续监测。
3. **人群适用性**:目前研究仅限于成人,儿童及青少年患者的疗效与安全性尚不明确。
4. **经济与可及性**:作为高科技疗法,成本可能极为昂贵,如何推广与医保覆盖仍是挑战。
七、未来展望
1. **更大规模的 III 期试验**:下一步需要在更大样本量中验证疗效与安全性,特别是不同人群的适用性。
2. **拓展至其他疾病**:类似策略可望应用于其他激肽相关疾病,甚至更多肝脏合成蛋白相关病症。
3. **规范长期随访**:建立国际多中心长期随访体系,确保疗效与安全性数据的完整性。
4. **产业化路径**:如果疗效与安全性得到确认,NTLA-2002 有望成为首个上市的体内 CRISPR 治疗罕见病药物。
八、结语
NTLA-2002 的临床结果标志着基因编辑疗法从“概念验证”走向“临床可行”的关键一步。它不仅为 HAE 患者带来了摆脱发作的希望,也为整个罕见病和慢性病治疗模式提供了新的可能性。未来,随着更多长期数据和多中心试验的积累,我们或许正在见证基因编辑真正改变医学实践的时刻。
