Tris-HCl缓冲液:生物实验中的”pH守护者”,从配制到应用的实战指南
在分子生物学实验室,有这样一种试剂:它既是DNA的溶剂”,又是蛋白质电泳的”稳定基石”;既能调节溶液酸碱度,又能参与生物分子的晶体生长——它就是Tris-HCl缓冲液。从PCR反应到蛋白质纯化,从核酸电泳到细胞培养,这种看似简单的缓冲液,却支撑着无数实验的顺利进行。本文将系统解析Tris-HCl缓冲液的核心特性、配制方法及实验应用,帮你彻底掌握这个生物实验的功臣”。
 来源:百度
来源:百度
一、认识Tris:缓冲液中的”多面手”
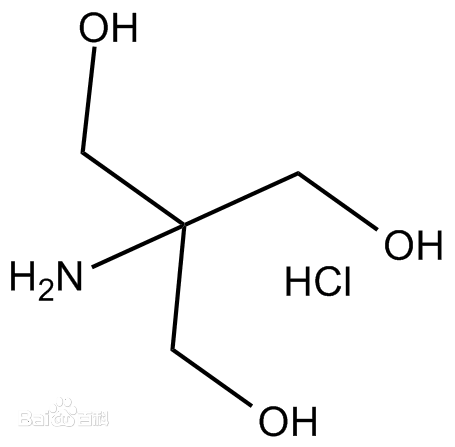
Tris的化学本质:三羟甲基氨基甲烷(Tris(hydroxymethyl)aminomethane),分子式(HOCH₂)₃CNH₂,是一种有机弱碱。在25℃时pKa值为8.1,这意味着它的有效缓冲范围在pH7.0-9.2之间,恰好覆盖了大多数生物分子的稳定pH区间(如蛋白质稳定pH通常为6.0-8.0,DNA为7.0-8.5)。
为什么Tris-HCl是实验室首选?
- 低离子强度:对蛋白质结构和酶活性影响小,适合作为生物大分子的溶剂
- 温度敏感性:温度每升高1℃,pH值降低约03个单位,可通过温度调节精确控制pH
- 兼容性强:能与EDTA、硼酸等配制成TE、TAE等复合缓冲液,满足不同实验需求
- 制备简单:仅需Tris碱和盐酸即可配制,无需复杂原料
Tris的”家族成员”:通过改变中和酸的种类,可衍生出多种缓冲液:
- Tris-HCl:最基础款,用于蛋白质溶解、细胞裂解
- TE缓冲液(Tris+EDTA):保护DNA免受核酸酶降解
- TAE缓冲液(Tris+乙酸+EDTA):核酸电泳常用,分辨率高
- TBE缓冲液(Tris+硼酸+EDTA):DNA测序首选,缓冲能力强
二、核心攻略:Tris-HCl缓冲液的配制方法
配制Tris-HCl缓冲液的核心是通过盐酸调节Tris碱溶液的pH值。以下是实验室最常用的浓度及pH值的详细配制步骤,新手也能一次成功!
(一)基础款:1M Tris-HCl缓冲液(pH7.4/7.6/8.0)
应用场景:蛋白质提取、Western blot转膜缓冲液、细胞培养液基础组分
配制原理:1M Tris溶液pH约为10.5,需加入浓盐酸中和至目标pH
【配制步骤】
- 称量溶解:称取1g Tris碱(分子量121.14),置于1L烧杯中,加入800ml去离子水,磁力搅拌至完全溶解(溶液澄清透明)。
- pH调节:用pH计监测,逐滴加入浓盐酸(12M HCl),边加边搅拌,按目标pH值控制盐酸用量:
- 4:约加70ml浓盐酸
- 6:约加60ml浓盐酸
- 0:约加42ml浓盐酸
⚠️关键提示:必须在溶液冷却至室温后再定容pH!温度对Tris的pH影响极大,热溶液调pH会导致室温时pH偏低0.3-0.5个单位。- 定容灭菌:将溶液转移至1L容量瓶,加去离子水定容至刻度,混匀后分装,121℃高压灭菌20分钟,室温保存。
【常见问题】
- pH值漂移:若灭菌后pH下降2以内属正常现象,可在配制时将目标pH提高0.2个单位预补偿
- 结晶析出:低温保存时Tris可能结晶,37℃水浴加热即可溶解,不影响使用
(二)高浓度款:1.5M Tris-HCl(pH8.8)
应用场景:SDS-PAGE凝胶配制(分离胶pH需8.8,浓缩胶用pH6.8 Tris-HCl)
配制特点:更高浓度的Tris可提供更强的缓冲能力,维持凝胶电泳过程中的pH稳定
【配制步骤】
- 称取7g Tris碱(1.5mol),加入800ml去离子水搅拌溶解
- 用浓盐酸调节pH至8(约需55-60ml),冷却至室温后定容至1L
- 无需灭菌(凝胶配制时需加丙烯酰胺等试剂,最终需过滤除菌),4℃保存
【凝胶配制中的关键作用】
在聚丙烯酰胺凝胶中,Tris-HCl不仅稳定pH,还与甘氨酸形成缓冲体系:电泳时甘氨酸在pH8.8的分离胶中解离为负离子,带动蛋白质迁移;进入pH6.8的浓缩胶后,甘氨酸解离度降低,蛋白质被压缩成紧密条带,实现高效分离。
(三)低浓度款:0.1M Tris-HCl(pH7.5)
应用场景:酶反应缓冲液、蛋白质洗脱液、抗体稀释液
配制优势:低离子强度减少对酶活性的抑制,适合精细的生化反应
【配制步骤】
- 称取11g Tris碱,加入800ml去离子水溶解
- 用1M HCl(而非浓盐酸)缓慢调节pH至5(约需85ml),避免局部过酸导致pH骤降
- 定容至1L,22μm滤膜过滤除菌(适用于对无菌要求高的酶反应),4℃保存
【浓度换算公式】
若需配制其他浓度(如0.05M、2M),可按以下公式计算Tris碱用量:
所需Tris质量(g)= 目标浓度(mol/L)× 体积(L)× 121.14(分子量)
(四)复合缓冲液:TE、TAE、TBE的配制
Tris-HCl常与EDTA等试剂配伍,形成功能更专一的缓冲液:
- TE缓冲液(10mM Tris-HCl + 1mM EDTA,pH8.0)
核心功能:DNA保存液(EDTA螯合Mg²⁺,抑制核酸酶活性)
配制方法:
- 取10ml 1M Tris-HCl(0)和2ml 0.5M EDTA(pH8.0),加去离子水定容至1L
- 高压灭菌后室温保存,DNA样品可在TE中4℃短期保存或-20℃长期保存
- TAE缓冲液(40mM Tris-乙酸 + 1mM EDTA,pH8.3)
核心功能:琼脂糖凝胶电泳(适合分离大片段DNA,如基因组DNA)
50×浓缩液配制:
- 242g Tris碱 + 57.1ml冰乙酸 + 100ml 0.5M EDTA(0),定容至1L
- 使用时用去离子水稀释50倍,工作液pH约3
- TBE缓冲液(89mM Tris-硼酸 + 2mM EDTA,pH8.3)
核心功能:DNA测序、小片段DNA电泳(缓冲能力强,不易出现pH梯度)
10×浓缩液配制:
- 108g Tris碱 + 55g硼酸 + 40ml 0.5M EDTA(0),定容至1L
- 稀释10倍后使用,注意:长期使用会在电泳槽中析出硼酸结晶,需定期更换
三、实验应用:Tris-HCl缓冲液的”万能场景”
Tris-HCl缓冲液凭借其独特的理化性质,在分子生物学实验中应用广泛,以下是典型场景的使用指南:
- 核酸提取与纯化
- 细胞裂解:0的Tris-HCl缓冲液(含EDTA和去污剂)可破坏细胞膜,同时抑制核酸酶活性。例如,提取细菌基因组DNA时,常用50mM Tris-HCl(pH8.0)+10mM EDTA的缓冲液,EDTA能螯合Mg²⁺,阻止DNase(依赖Mg²⁺的核酸酶)降解DNA。
- DNA溶解:TE缓冲液(10mM Tris-HCl pH8.0 + 1mM EDTA)是DNA的”最佳溶剂”。DNA在弱碱性环境中更稳定,EDTA可长期抑制残留核酸酶活性,-20℃保存可稳定数年。
- 电泳分离:
- 琼脂糖凝胶电泳:常用TAE缓冲液(3),适合分离大片段DNA(如基因组DNA、质粒),其低离子强度可减少电流产热,保护DNA完整性;
- 聚丙烯酰胺凝胶电泳(PAGE):用于小片段DNA(如寡核苷酸、PCR产物)分离,需用TBE缓冲液(3),硼酸能增强缓冲能力,避免电泳过程中pH波动影响分离效果。
- 蛋白质研究
- 蛋白质提取:4-7.6的Tris-HCl缓冲液(20-50mM)是常规选择。例如,提取细胞总蛋白时,缓冲液中加入NaCl(150mM)可维持生理离子强度,减少蛋白质聚集;加入蛋白酶抑制剂(如PMSF)可保护蛋白质不被降解。
- SDS-PAGE凝胶配制:
- 分离胶:5M Tris-HCl(pH8.8),高浓度Tris提供强缓冲能力,确保电泳过程中pH稳定,使蛋白质按分子量大小分离;
- 浓缩胶:5M Tris-HCl(pH6.8),与电极缓冲液(Tris-甘氨酸,pH8.3)形成pH梯度,将蛋白质样品压缩成紧密条带,提高分离分辨率。
- 酶活性测定:低浓度Tris-HCl(10-50mM,5-8.0)常用于酶反应体系。例如,测定DNA聚合酶活性时,Tris-HCl缓冲液可维持反应pH稳定,且不干扰酶与底物的结合(离子强度低,避免竞争性抑制)。
- 细胞培养与组织工程
- 培养基pH调节:Tris-HCl缓冲液的pKa值(06)接近细胞培养常用pH(7.2-7.4),可有效抵抗培养基因代谢产生的酸性物质(如CO₂、乳酸),维持pH稳定。例如,无血清培养基中常添加20mM Tris-HCl(pH7.4),配合HEPES使用可增强缓冲效果。
- 细胞洗涤与消化:胰蛋白酶消化细胞时,常用05%胰酶+0.53mM EDTA的Tris-HCl缓冲液(pH7.4),温和的离子环境减少对细胞活性的影响;洗涤细胞时,PBS缓冲液(含Tris-HCl)可快速去除残留培养基成分。
- 三维细胞培养:Tris-HCl缓冲液的低离子强度适合纤维蛋白凝胶的形成,在干细胞分化实验中,常通过调节Tris-HCl浓度(50-100mM)控制凝胶硬度,模拟体内微环境。
- 分子诊断与检测
- PCR反应体系:标准PCR缓冲液含10mM Tris-HCl(3,25℃),反应升温至95℃时pH降至7.2左右,接近Taq DNA聚合酶的最适pH(7.5),确保酶活性最大化。
- 免疫印迹(Western blot):转膜缓冲液需用25mM Tris-HCl(3)+192mM甘氨酸+20%甲醇,Tris与甘氨酸形成缓冲对,维持转膜过程中电场稳定,甲醇可增强蛋白质与膜的结合力。
- ELISA检测:包被缓冲液常用50mM Tris-HCl(6),弱碱性环境促进抗原抗体吸附;洗涤缓冲液(PBST)中加入0.05% Tween-20和Tris-HCl(pH7.4),可减少非特异性结合,提高检测灵敏度。
- 特殊实验场景
- 蛋白质复性与重折叠:Tris-HCl缓冲液(0,50mM)因良好的溶解性和适宜离子强度,常用于变性蛋白质的复性。例如,包涵体蛋白复性时,缓冲液中加入尿素(6-8M)和还原剂(DTT),Tris-HCl可维持复性过程中的pH稳定,减少蛋白质聚集。
- 金属离子检测:Tris-HCl缓冲液不与钙、镁等金属离子反应,适合作为酶法检测金属离子的缓冲体系。例如,测定血清钙含量时,Tris-HCl缓冲液可避免金属离子沉淀,确保显色反应准确。
四、避坑指南:配制与使用的关键注意事项
- 温度对pH的影响:
Tris的pH值随温度变化显著(温度每升高1℃,pH降低03)。例如,4℃冰箱保存的1M Tris-HCl(pH8.0),取出至37℃温育后pH会降至7.7左右。解决方案:配制时在实验温度下调节pH(如细胞培养需37℃调pH,低温实验需4℃调pH)。 - 浓度与缓冲能力:
缓冲液浓度需根据实验需求调整:酶反应常用10-50mM,避免高浓度抑制酶活性;电泳或细胞培养需20-100mM,确保缓冲能力。警惕:浓度低于5mM时,Tris-HCl缓冲能力显著下降,易受外界酸碱干扰。 - 灭菌与保存:
- 用于细胞培养或酶反应的缓冲液需过滤除菌(22μm滤膜),避免高压灭菌破坏成分;
- 含EDTA的缓冲液(如TE、TAE)可高压灭菌,但需冷却后调pH,防止EDTA高温分解;
- 配好的缓冲液室温保存不超过6个月,4℃可延长至1年,出现浑浊或沉淀需丢弃。
- 避免与金属离子反应:
Tris-HCl虽不与钙、镁等常见离子反应,但会与重金属(如Cu²⁺、Fe³⁺)形成络合物。若实验涉及金属离子,需提前用EDTA螯合去除,或改用PBS缓冲液。
- 避免与金属离子反应:
