外泌体鉴定之Western Blot:电泳技术核心原理与实验流程
Western Blot(WB)是外泌体鉴定的“金标准”之一,通过检测CD63、CD81、TSG101等标志性蛋白,结合阴性对照(如Calnexin)验证外泌体纯度。其中,电泳步骤是分离外泌体蛋白、确保条带清晰的关键。本文详细解析外泌体WB电泳的核心原理、凝胶选择、操作流程及常见问题解决方案,帮你轻松获得理想结果。
一、外泌体WB电泳的核心原理:按分子量分离蛋白
外泌体蛋白需通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,其原理基于 “电荷效应”和“分子筛效应”:
- 电荷效应:SDS使蛋白带负电
- 外泌体蛋白与 SDS(阴离子去污剂)结合(1分子蛋白结合4分子SDS),掩盖天然电荷,使所有蛋白带 均匀负电荷,电泳时仅按分子量大小迁移。
- 还原剂(如β-巯基乙醇)断裂蛋白二硫键,破坏空间结构,确保蛋白线性化,迁移速率仅与分子量相关。
- 分子筛效应:凝胶孔径决定分离范围
– 聚丙烯酰胺凝胶由浓缩胶和分离胶组成:
– 浓缩胶(pH 6.8):孔径大,样品在此被压缩成“薄层”,减少条带扩散;
– 分离胶(pH 8.8):孔径小,分子量差异大的蛋白分离效果更显著(如CD63/53kDa与TSG101/45kDa)。
二、凝胶浓度选择:根据外泌体标志物分子量精准匹配
外泌体标志物分子量差异大(24-95kDa),需根据目标蛋白选择合适的分离胶浓度,确保条带清晰分离:
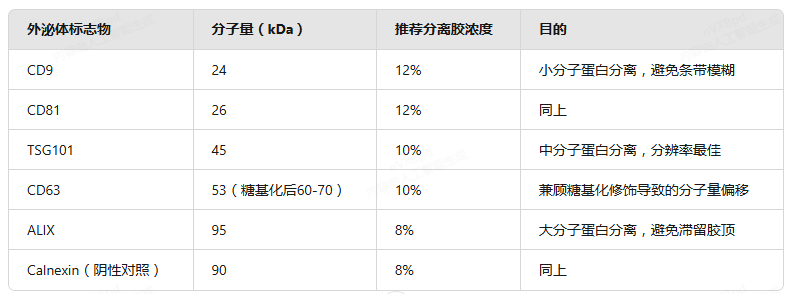
三、详细实验流程:从样本处理到电泳结束
- 外泌体蛋白提取与定量
(1)蛋白提取
– 外泌体沉淀用 RIPA裂解液(含1% SDS、蛋白酶抑制剂)重悬,冰上裂解30分钟(期间涡旋3次,每次10秒);
– 12,000×g离心(4℃,10分钟),取上清(避免未裂解的囊泡沉淀干扰)。
(2)BCA定量
– 按BCA试剂盒说明书操作,测定蛋白浓度(外泌体蛋白浓度通常为0.1-1μg/μL);
– 根据目标蛋白丰度调整上样量:高丰度标志物(如CD63)上样5-10μg,低丰度标志物(如CD81)上样10-20μg。
- 样品变性与上样
(1)变性处理
– 按 4:1比例混合蛋白样品与5×Loading Buffer(含SDS、β-巯基乙醇),95℃加热5分钟(彻底变性),冰上冷却5分钟。
(2)上样技巧
– 用微量注射器缓慢将样品注入加样孔(避免气泡),每孔上样体积≤20μL(避免溢出);
– 左侧加 蛋白Marker(如10-180kDa),用于分子量参考;右侧留1-2个空白孔(加等量Loading Buffer,排除背景干扰)。
- 电泳参数设置与运行
(1)浓缩胶阶段(低电压压缩样品)
– 恒压 80V,电泳30-40分钟,至溴酚蓝(Loading Buffer指示剂)进入分离胶(约距浓缩胶-分离胶界面1cm)。
(2)分离胶阶段(高电压分离蛋白)
– 调整电压至 120V,继续电泳60-90分钟,至溴酚蓝距凝胶底部1cm时停止(避免小分子蛋白跑出胶外)。
- 电泳结束后处理
– 小心剥离凝胶,放入 转膜缓冲液 中平衡10分钟(避免胶干裂),准备转膜。
四、常见问题与解决方案:电泳条带异常的“急救指南”
- 条带模糊/弥散(最常见问题)
– 可能原因:
① 凝胶浓度不当(如用8%胶分离24kDa的CD9,孔径过大导致条带扩散);
② 上样量过高(>20μg,蛋白过载);
③ 加热变性不充分(蛋白未完全线性化)。
– 解决方案:
– 按分子量选择凝胶浓度;
– 降低上样量(如10μg),或增加凝胶厚度(1.5mm胶代替1mm胶);
– 95℃加热时间延长至7分钟,确保彻底变性。
- 条带歪斜/弯曲
– 可能原因:
① 凝胶聚合不均匀(TEMED或AP浓度不当);
② 电泳槽缓冲液液面不一致(内槽液面低于外槽,导致电场不均匀)。
– 解决方案:
– 现配凝胶,TEMED和AP按比例添加(10mL胶加5μL TEMED、50μL 10% AP);
– 确保内槽缓冲液淹没凝胶上沿,外槽缓冲液没过电极。
- Marker条带不清晰
– 可能原因:Marker未充分变性(未加热或加热时间不足);
– 解决方案:Marker单独加热(95℃,5分钟),上样前混匀。
- 无条带(电泳阶段问题)
– 可能原因:
① 电极接反(蛋白向反方向迁移出胶);
② 电泳时间过长(溴酚蓝跑出胶外,小分子蛋白丢失)。
– 解决方案:
– 确认电极正负极(红色接正极,黑色接负极);
– 密切观察溴酚蓝位置,提前5分钟停止电泳。
五、关键注意事项:确保电泳结果可重复
- 凝胶质量:现配现用,避免反复冻融(AP易失效);
- 缓冲液:SDS电泳缓冲液可重复使用2-3次,pH需维持在8.3(超过8.5需重新配制);
- 温度控制:电泳时凝胶温度<30℃(温度过高会导致条带弥散),可打开电泳槽盖散热;
- 记录参数:详细记录凝胶浓度、电压、电泳时间,确保实验可重复。
