qPCR(实时荧光定量PCR)实验需要注意以下多个方面
qPCR(实时荧光定量PCR)实验需要注意以下多个方面:
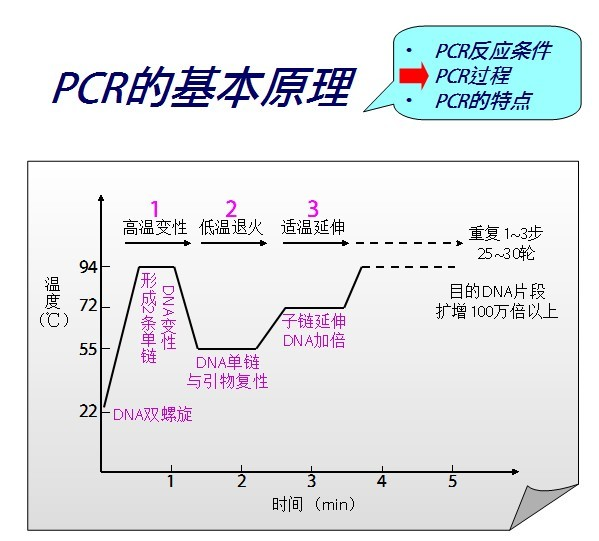
https://custom.dxycdn.com/trademd/upload/pic/2016/03/03/A1456982333073uwznn6fpuq.jpg
样本处理
• 样本采集:确保采集的样本能代表研究对象,采集过程要迅速,防止RNA降解或DNA变化,如采集组织样本时应立即放入液氮或RNA保护剂中。
• 核酸提取:选择合适的提取方法和试剂盒,保证核酸纯度和完整性,避免蛋白、盐离子等杂质残留,提取后可通过琼脂糖凝胶电泳和分光光度计检测评估质量。
• 核酸保存:提取的核酸若不能及时使用,应置于-80℃保存,避免反复冻融,RNA需特别注意防止降解。
引物与探针设计及选择
• 引物设计:长度一般为18-25bp,GC含量40%-60%,上下游引物Tm值相差不超过5℃,避免引物二聚体和发卡结构,通过BLAST分析确保特异性。
• 探针选择:若使用探针法,探针的Tm值应比引物高5-10℃,5’端不能为G碱基,荧光基团和淬灭基团选择要合适,且与仪器检测通道匹配。
反应体系配置
• 试剂质量:选用高质量的qPCR试剂,包括DNA聚合酶、dNTPs、缓冲液等,关注试剂的保质期和保存条件。
• 体系比例:按照试剂盒说明书精确配置各成分比例,如模板、引物、探针、酶等的浓度要准确,Mg²⁺浓度对反应影响较大,需优化。
• 避免污染:配置体系应在专门的洁净区域,使用带滤芯的枪头,避免试剂间交叉污染,可设阴性对照监测污染情况。
仪器操作与实验条件设置
• 仪器校准:定期对qPCR仪器进行校准和维护,检查荧光检测系统等是否正常,确保结果准确可靠。
• 反应程序:根据引物、模板和试剂特点优化反应程序,包括预变性、变性、退火、延伸的温度和时间,尤其退火温度需通过预实验确定。
• 加样操作:加样要准确、快速,避免产生气泡,确保反应体系均匀,加样后及时放入仪器,防止样本长时间放置影响结果。
数据分析
• 标准曲线制作:标准曲线的相关系数应大于0.99,斜率在-3.1至-3.6之间,以保证定量准确性,标准品浓度梯度要合理。
• 结果重复性:实验应设置生物学重复和技术重复,变异系数(CV)一般应小于15%,若结果重复性差,需查找原因重新实验。
• 阈值设定:阈值应设定在荧光信号指数增长期,且要保持一致,避免因阈值设定不同影响结果分析。
