RNA pull down 实验原理与步骤
在分子生物学研究中,了解 RNA 与蛋白质之间的相互作用对于揭示基因表达调控、RNA 代谢等生物学过程至关重要。RNA pull down 实验是一种有效的技术,用于检测和鉴定与特定 RNA 分子相互作用的蛋白质。本文将详细介绍 RNA pull down 实验的原理和步骤。
二、实验原理
RNA pull down 实验基于亲和纯化的原理。首先,通过体外转录或其他方法合成生物素标记的特定 RNA 分子。然后,将该 RNA 与细胞裂解液或纯化的蛋白质提取物孵育,使与该 RNA 相互作用的蛋白质结合到 RNA 上。接着,利用与生物素具有高亲和力的链霉亲和素包被的磁珠或琼脂糖珠,将结合了蛋白质的 RNA 从溶液中分离出来。经过洗涤去除未结合的蛋白质后,将结合在 RNA 上的蛋白质复合物洗脱下来,并通过各种方法进行分析鉴定。
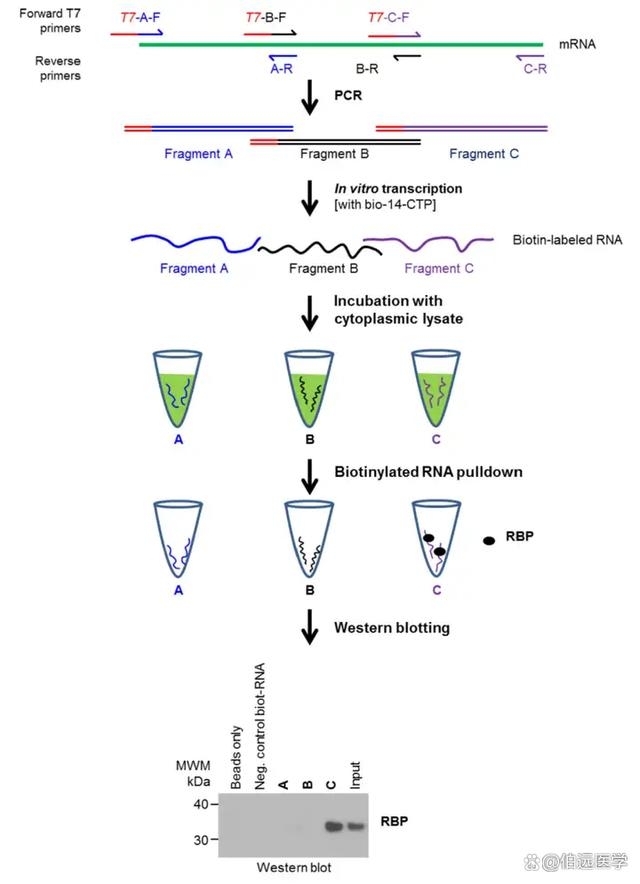
来源:百度
三、实验步骤
- RNA 探针的制备
– 根据研究目的,选择特定的 RNA 分子,如 mRNA、lncRNA、miRNA 等。
– 通过体外转录、化学合成或其他方法制备生物素标记的 RNA 探针。确保 RNA 探针的纯度和质量,避免 RNA 降解和污染。
- 蛋白质样品的制备
– 准备含有可能与特定 RNA 相互作用的蛋白质的样品。可以是细胞裂解液、纯化的蛋白质提取物或体外表达的蛋白质。
– 为了减少非特异性结合,可以对蛋白质样品进行预处理,如去除核酸、调整离子强度等。
- RNA 与蛋白质的孵育
– 将生物素标记的 RNA 探针与蛋白质样品在适当的缓冲液中进行孵育。孵育时间、温度和缓冲液的组成等条件需要根据实验进行优化。
– 孵育过程中,与特定 RNA 相互作用的蛋白质会结合到 RNA 探针上。
- 亲和纯化
– 加入链霉亲和素包被的磁珠或琼脂糖珠,使结合了蛋白质的 RNA 与磁珠或琼脂糖珠结合。
– 通过磁场或离心的方法将磁珠或琼脂糖珠与溶液分离,去除未结合的蛋白质。
- 洗涤
– 用洗涤缓冲液对结合了蛋白质复合物的磁珠或琼脂糖珠进行多次洗涤,以去除未结合的蛋白质和非特异性结合的杂质。
– 洗涤缓冲液的组成和洗涤次数需要根据实验进行调整,以确保去除非特异性结合的同时不影响特异性结合的复合物。
- 洗脱和分析
– 使用适当的洗脱缓冲液将结合在 RNA 探针上的蛋白质复合物洗脱下来。洗脱缓冲液的选择应能够破坏 RNA 与蛋白质之间的相互作用,但不影响蛋白质的活性。
– 洗脱下来的蛋白质复合物可以通过多种方法进行分析鉴定,如 SDS-PAGE 电泳、Western blot、质谱分析等。这些方法可以确定与特定 RNA 相互作用的蛋白质的身份、相对丰度以及结合特性。
四、注意事项
- RNA 探针的质量:确保 RNA 探针的纯度和质量,避免 RNA 降解和污染。可以通过琼脂糖凝胶电泳、紫外分光光度计等方法检测 RNA 探针的质量。
- 蛋白质样品的处理:对蛋白质样品进行适当的预处理,以减少非特异性结合。同时,要注意保持蛋白质的活性和稳定性。
- 实验条件的优化:孵育时间、温度、缓冲液组成等实验条件需要根据实验进行优化,以提高实验的灵敏度和特异性。
- 对照实验的设置:设置适当的对照实验,如使用没有生物素标记的 RNA 作为阴性对照,或者使用已知相互作用的 RNA 和蛋白质作为阳性对照,以排除非特异性结合和其他干扰因素的影响。
- 数据分析:对实验结果进行准确的数据分析是得出可靠结论的关键。要注意区分特异性结合和非特异性结合,结合多种分析方法和对照实验,以提高结果的可信度。
