心胸外科和干细胞衍生的外泌体(SC-Exo)疗法
 图片来源于知乎“知行君”
图片来源于知乎“知行君”
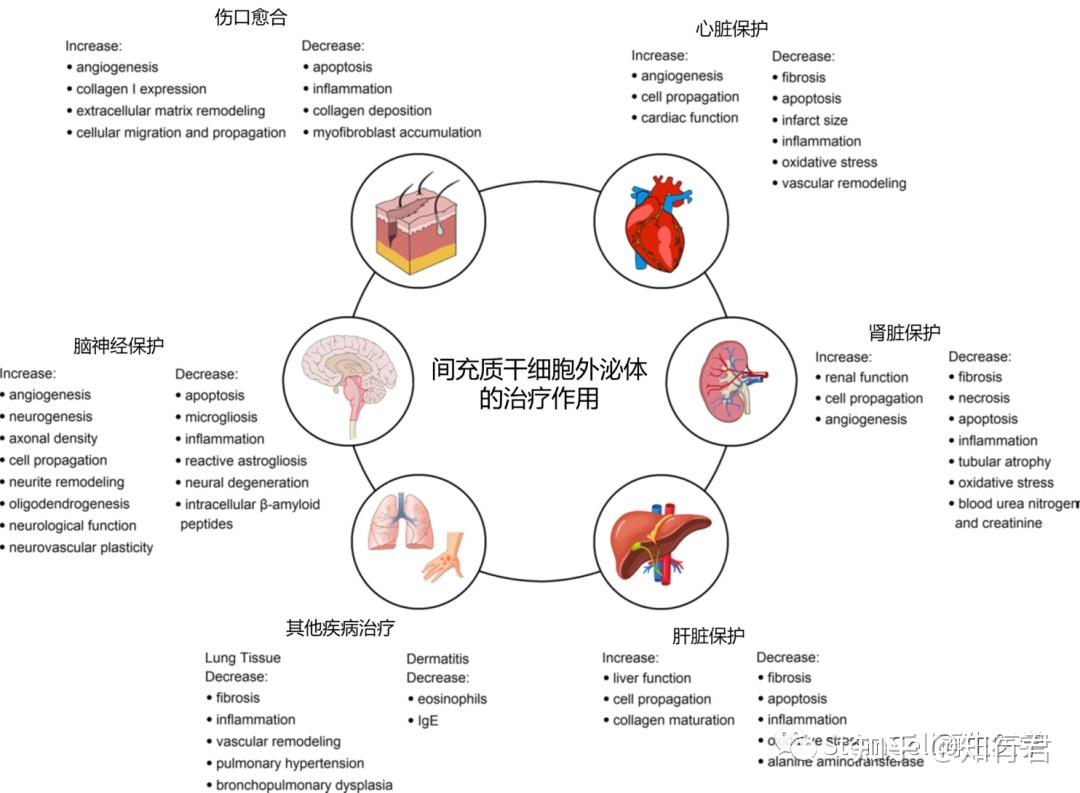
世界主要死亡率是缺血性心脏病(IHD),它主要由阻塞性冠状动脉粥样硬化引起。动脉粥样硬化斑块破裂是导致心肌梗死(MI)的急性动脉血栓形成的最常见诱因。心肌长期缺氧可导致心肌细胞死亡。虽然及时再灌注是必不可少的,但可能会发生心肌 IRI,从而减轻再灌注的有益影响。尽管存在现代冠状动脉再灌注,但与急性MI导致心力衰竭相关的死亡率和发病率仍然很高,这凸显了下一代心脏保护疗法(如 SC-exo)的重要性。
Xing 等人进行的工作主要集中在动脉粥样硬化上。脂肪MSC衍生的外泌体 miR-342-5p在 H2O2攻击的HUVEC模型中通过靶向 PPP1R12B 显示保护内皮细胞免受动脉粥样硬化。Peng 等人和Gao等人所做的工作主要集中在 MI 上。来自MSCs的外泌体miR-25-3p可以通过靶向OGD心肌细胞模型和左前降支结扎动物模型中的促凋亡蛋白和 EZH2来缓解MI。同样,人类 iPSC 衍生的外泌体可以改善 MI 的恢复,而不会增加猪模型中致心律失常并发症的频率。温等人和 Santoso 等人所做的工作集中在心肌细胞的死亡上。MSC来源的外泌体可以通过靶向 PTEN/Akt 通路通过miR-144改善低氧条件下的心肌细胞凋亡,而iPSC来源的外泌体可以调节低氧心肌细胞中的自噬。Katsur 等人和Chen等人都专注于心肌IRI。前者团队发现,来源于非心肌细胞相关细胞(即 CTX0E03 NSCs)的外泌体可以减小梗死面积,同时延迟心肌细胞线粒体通透性转换孔通过 JAK/STAT 通路的打开。后者团队发现,MSC衍生的外泌体miR-143-3p可以通过CHK2-Beclin2通路调节自噬来抑制心肌IRI。最后,Chen及其同事证明骨髓MSC衍生的外泌体可以减轻压力超负荷诱导的重塑中的心脏肥大和纤维化,从而为心力衰竭提供有前途的潜在治疗方法。
与 MSC 衍生的外泌体相比,来自 ESC 的外泌体对心脏病表现出相当的治疗效果。在保护心肌细胞方面,Khan 等人发现ESC衍生的外泌体miR-294可以提高心肌细胞存活,促进心肌血管形成并抑制心肌梗死后纤维化,从而增强心肌梗死后心脏功能。此外,Tavakoli Dargagni 等人证明,ESC衍生的外泌体可以通过抑制TLR4-NLRP3介导的心肌细胞焦亡来减轻阿霉素诱导的心脏毒性。同样,Singla 的团队表明,ESC衍生的外泌体可以通过增强抗炎M2巨噬细胞和减少炎症诱导的焦亡来改善心脏重塑。在心力衰竭的管理方面,Pang等人表明,ESC 衍生的外泌体可以通过横主动脉缩窄诱导的心力衰竭模型中的FGF2信号传导减轻心力衰竭、改善心脏功能并促进心肌血管生成。Kervadec 等人使用冠状动脉闭塞诱导的心力衰竭模型表明,ESC 衍生的心血管祖细胞分泌的外泌体可以恢复心脏功能,例如左心室收缩末期和舒张末期容积减少。最后,同一个研究小组后来证明,来自更容易获得的细胞来源(例如 iPSC)的外泌体能够产生类似于ESC衍生的外泌体所提供的心脏保护作用。
SC-exo的其他重要亚型,如 iPSC-exo、HSC-exo和 EPC-exo,也表现出心脏保护作用。例如,iPSCs 分泌的外泌体可以发挥细胞保护作用,维持细胞内Ca2+稳态和促进心肌细胞存活,从而促进 MI。HSC-exo 可以降低心脏损伤相关指标和心脏纤维化程度,同时提高心力衰竭动物模型中的射血分数。此外,全身输注HSC衍生的外泌体可以改善急性MI大鼠模型中的缺血性心肌病,在治疗肾损伤等副作用方面具有额外的益处。使用血管生成因子sonic hedgehog(Shh)修饰 HSC可以通过将外泌体 Shh输送到缺血心肌来保持急性MI后的心脏功能。Ke等人证明 EPC衍生的外泌体可以通过激活间充质-内皮转化和降低HMGB1 的表达来增强心脏成纤维细胞的增殖和血管生成,后来揭示来自EPC衍生的外泌体的外泌体 miR-218-5p 和 miR-363-3p 可以通过靶向 p53/JMY 通路改善MI。在Yue 等人的一项有趣研究中,发现 IL-10 缺陷诱导的全身炎症通过上调外泌体中整合素连接激酶(ILK)的富集和ILK介导的受体细胞中 NF-κB通路的激活,损害了EPC衍生的外泌体对心肌修复的修复特性。
在胸部疾病的治疗方面,Liu 等人证明,人ESCs衍生的外泌体可以缓解博来霉素诱导的肺纤维化小鼠的炎症,防止胶原蛋白过度沉积并保留肺泡结构。这是通过靶向血小板反应蛋白2 的外泌体 mi-17-5p实现的。同样,周等人证明,来自iPSC衍生的外泌体的外泌体 miR-302a-3p可以通过TET1抑制M2巨噬细胞,从而减轻肺纤维化。Liu 等人表明,EPC 衍生的外泌体可以通过调节Mitofusin-2和Ras-Raf-ERK1/2通路来抑制肺动脉平滑肌细胞增殖及其对细胞凋亡的抵抗,从而作为治疗肺动脉高压的潜在治疗候选者。两个独立的团队都揭示了人EPC衍生的外泌体可以部分通过将miR-126输送到受伤的肺泡中来改善LPS诱导的急性肺损伤的结果。Zhang等人发现EPC衍生的外泌体可以提高肺微血管内皮细胞的生物活性,并保护它们在发育中的肺血管系统中免受高氧损伤,从而有助于治疗支气管肺发育不良。此外,Montay-Gruel 等人证明,人类ESC衍生的外泌体可以改善与肺部暴露于电离辐射相关的不良晚期正常组织并发症,例如在肺癌术后治疗期间遇到的并发症。
以上内容来源于PUBMED文章《Clinical applications of stem cell-derived exosomes》
