脐带血变’抗癌武器库’!中国团队突破细胞治疗量产难题
一管脐带血,造出千万抗癌细胞?中国新突破来了
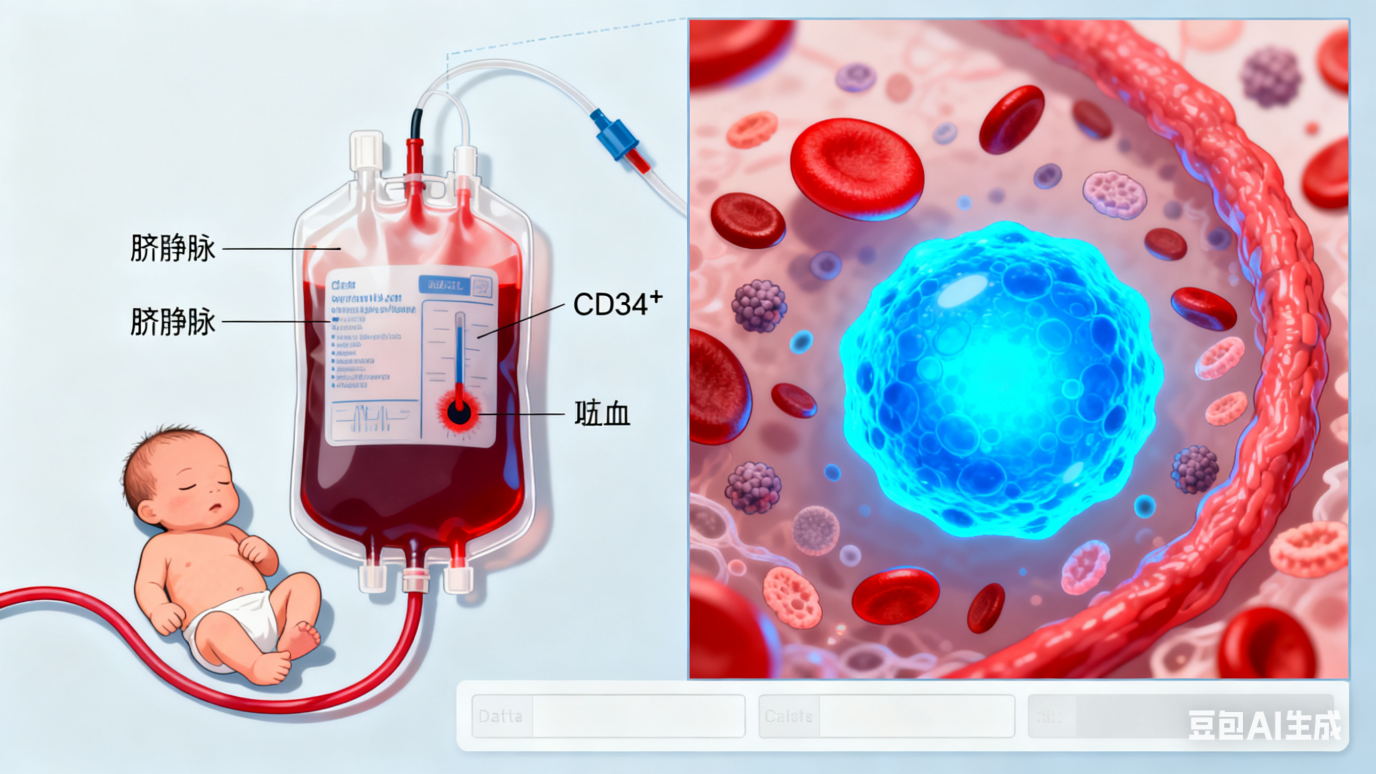
“120 万一针的 CAR-T 疗法” 曾让癌症患者望而却步,核心难题在于细胞制备成本高、产量低 —— 在适用患者中,仅不足 10% 能负担得起商业化产品。但 2025 年 10 月,中国科学院动物所王金勇团队与血液病医院竺晓凡团队在《Nature Biomedical Engineering》发表的研究,给无数患者带来新希望:他们用单份脐带血就能批量生产 “抗癌士兵” iNK 细胞和 CAR-iNK 细胞,产量较传统方法提升千倍以上。
三步造出 “超级抗癌细胞”,到底有多牛?
团队开发的 “三步制备法” 堪称 “细胞工厂流水线”,从脐带血中的 CD34⁺造血干祖细胞出发,42 天即可完成量产:
- 干祖细胞扩增:用 AFT024 专用滋养细胞培养 CD34⁺细胞 14 天,使其数量暴涨 1000 倍,且 60% 以上仍保持干细胞特性;
- 类器官定向诱导:将扩增后的细胞制成 50 个微型类器官,模拟体内环境诱导 14 天,收获超 1 亿个 CD45⁺免疫前体细胞,诱导效率达 200 倍;
- 成熟增殖:最后 14 天让细胞定向发育,最终单份脐带血可产出1400 万 – 8300 万 iNK 细胞或700 万 – 3200 万 CAR-iNK 细胞,其中 CD45⁺CD56⁺细胞纯度超 99%。
更惊人的是,若延长培养至 49 天,单个干祖细胞的诱导效率可达 8000 万倍,理论上 1/5 份脐带血能造 1 万亿个细胞,按每剂 10 亿 – 100 亿细胞计算,够 760-83000 人次使用!这些细胞中 CD16 表达比例达 37.4%-69.4%,证明成熟度极高,冷冻复苏后仍保持活性。
这项技术解决了 3 大临床痛点
- 产量瓶颈:传统方法 1 份脐带血仅能满足 1 次治疗,新方法可支持多次高剂量输注 —— 这对弥补 NK 细胞疗效持续时间短的缺陷至关重要;
- 安全性升级:几乎无 T 细胞污染,从根源上避免了致命的移植物抗宿主病(GvHD),而 CAR-T 疗法中这类风险始终存在;
- 成本大降:CAR 基因改造的病毒用量仅为传统方法的 1/14 万 – 1/60 万,大幅压缩成本。对比加州大学洛杉矶分校类似研究中 “单剂成本降至 5000 美元” 的目标,中国技术在成本控制上更具优势。
实验中,这些 “抗癌士兵” 表现亮眼:体外高效杀伤白血病、实体瘤细胞,在人源肿瘤细胞系模型(CDX)和病人来源肿瘤模型(PDX)中,均能显著延长荷瘤小鼠生存期。
脐带血:从 “生命备份” 到 “药物源泉”
过去脐带血常被视为 “废弃物”,如今却是细胞治疗的 “宝藏原料”。北京市脐带血库数据显示,32 万份储存脐血已救助 2200 多位患者,除白血病外,还在脑瘫、孤独症等神经疾病中显效。
王金勇团队的突破更让脐带血价值升级:传统脐血库是 “生物备份库”,现在通过技术转化可成为 “抗癌药物工厂”。专家点评称,这让 “货架式” 细胞治疗成为可能 —— 提前备好 CAR-iNK 细胞,患者无需像等待 CAR-T 那样耗时定制,当天即可输注,这与浙江大学团队开发的通用型 CAR-NK 技术形成互补,共同推动免疫治疗标准化。
技术突破背后的科学逻辑
这项成果的核心创新在于 “节点前移”:将 CAR 基因改造从成熟 NK 细胞阶段,提前到 CD34⁺干祖细胞阶段。传统方法在成熟细胞上改造,不仅病毒用量大、成本高,还可能损伤细胞功能;而干祖细胞改造后仍能正常分化成熟,CAR 表达比例平均达 60%,为后续开发其他免疫细胞亚型提供了可借鉴的框架。
目前团队仍在攻关:如何用人源细胞替代鼠源滋养细胞,进一步提升临床相容性;如何深化 NK 细胞分化机制研究,提高效能。这些探索将加速技术落地。
未来:抗癌疗法将更精准、更普惠
目前 CAR-iNK 细胞已在血液瘤治疗中展现潜力,下一步计划推进实体瘤临床试验。更值得期待的是,该技术可适配不同 CAR 靶点,未来或用于卵巢癌、肺癌等多种癌症。
正如王金勇研究员所说:“脐带血里的每一个干祖细胞,都可能成为对抗癌症的种子。” 随着技术落地,曾经的 “天价抗癌药” 或许会降至普通家庭可承受范围,结合脐带血 “一次储存、多次利用” 的特性,免疫疗法将真正惠及大众。
