实体瘤 CAR-T 的“中国经验”:CLDN18.2 CAR-T 在消化道肿瘤中的 I 期最终结果
一、引子:CAR-T 的实体瘤难题
CAR-T 细胞疗法在血液肿瘤领域已经取得突破性进展,CD19 靶向 CAR-T 治疗复发难治 B 细胞恶性肿瘤的疗效已被广泛证实,并成功推动多个产品上市。然而,在实体瘤领域,CAR-T 的进展远不如血液肿瘤顺利。其主要挑战包括:肿瘤微环境的免疫抑制、CAR-T 在实体瘤局部浸润不足、以及靶点选择的安全性问题。因此,如何找到合适的靶点,并在保证安全的同时发挥抗肿瘤作用,一直是研究热点。
二、CLDN18.2:胃癌等消化道肿瘤的新兴靶点
CLDN18.2(Claudin18.2)是一种紧密连接蛋白的亚型,在正常胃黏膜上皮中有限表达,但在胃癌、胰腺癌等消化道肿瘤中高表达,且在大多数其他正常组织中极低或不表达。因此,CLDN18.2 被认为是较为理想的实体瘤免疫治疗靶点。此前,抗 CLDN18.2 单抗 zolbetuximab 已在胃癌中显示出积极结果,而 CLDN18.2 CAR-T 则代表了进一步的探索。
三、研究设计:I 期临床试验框架
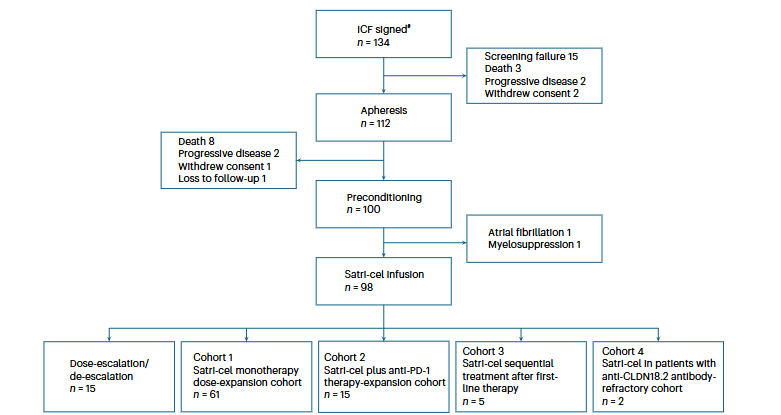
这项发表于 2024 年《Nature Medicine》的 I 期研究,是首个系统报告 CLDN18.2 靶向 CAR-T 在消化道肿瘤中应用的临床试验。研究纳入了 37 例晚期消化道实体瘤患者,主要包括胃癌和胰腺癌。

设计要点包括:
1. **入组标准**:既往多线治疗失败,ECOG 评分 ≤1,肿瘤组织检测 CLDN18.2 高表达;
2. **治疗方案**:患者接受淋巴清除化疗(氟达拉滨+环磷酰胺),随后输注自体 CLDN18.2 CAR-T 细胞;
3. **研究终点**:主要为安全性与耐受性,次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、无进展生存期(PFS)和总生存期(OS)。
四、主要结果:安全性与有效性并存
1. **安全性**
CAR-T 最主要的不良反应是细胞因子释放综合征(CRS)。本研究中,约 90% 的患者出现 CRS,但绝大多数为 1–2 级,仅有 2 例出现 3 级以上事件,经对症处理后均缓解。未见明显神经毒性。少数患者出现胃肠道不良事件,但总体可控。整体安全性较为理想。
2. **有效性**
在 37 例患者中,客观缓解率达到 48.6%,疾病控制率超过 70%。其中部分患者实现完全缓解。中位无进展生存期约 4.5 个月,中位总生存期超过 9 个月。对于晚期消化道肿瘤患者而言,这一结果已属突破。
3. **生物标志物探索**
研究发现,CLDN18.2 表达水平越高,患者获益越显著。同时,部分患者在治疗后外周血中检测到 CAR-T 扩增和持久存在,与疗效呈正相关。
五、与其他实体瘤 CAR-T 的比较
在其他实体瘤 CAR-T 试验中,疗效普遍有限,ORR 多在 10–20% 左右。而 CLDN18.2 CAR-T 的 ORR 接近 50%,显示出独特优势。这表明,合适的靶点选择对实体瘤 CAR-T 的成功至关重要。
六、临床意义与前景
1. **突破实体瘤困境**:该研究首次证明 CAR-T 在消化道肿瘤中可实现较高缓解率,为实体瘤免疫治疗提供了“可行性证据”。
2. **推动靶点药物开发**:CLDN18.2 作为新靶点,正在多条研发管线中推进,包括 CAR-T、双抗、ADC 等,可能形成完整的药物谱系。
3. **为临床转化奠定基础**:如果后续 II/III 期研究进一步验证安全性和疗效,CLDN18.2 CAR-T 有望成为全球首个实体瘤 CAR-T 获批产品。
七、局限与挑战
尽管结果积极,但仍存在挑战:
1. **样本量有限**:仅 37 例患者,且随访时间有限;
2. **持久性不足**:部分患者在数月后出现复发,提示 CAR-T 在实体瘤微环境中的持久作用仍有限;
3. **生产工艺与可及性**:CAR-T 属于个体化制备,成本高昂且周期长;
4. **靶点异质性**:部分肿瘤患者 CLDN18.2 表达水平低,限制了适用范围。
八、未来方向
1. **联合疗法探索**:与免疫检查点抑制剂、溶瘤病毒或放疗联合,以改善微环境免疫抑制。
2. **工艺优化**:改进 CAR-T 结构(如装配双靶点 CAR、增加因子分泌)以增强持久性。
3. **患者筛选**:通过精准检测 CLDN18.2 表达水平,挑选最可能获益的患者。
4. **全球化发展**:中国团队的成功经验将推动全球在实体瘤 CAR-T 领域的布局。
九、结语
CLDN18.2 CAR-T 在消化道肿瘤中的 I 期最终结果显示出突破性的安全性和疗效,这是中国科研团队在实体瘤免疫治疗上的重要里程碑。它不仅为难治性胃癌、胰腺癌患者带来新希望,也为全球实体瘤 CAR-T 研究提供了范例。未来,随着临床试验的深入和技术的优化,CLDN18.2 CAR-T 有望成为实体瘤免疫治疗的重要支柱。
